题目内容
(11分)实验室需要0.80 mol/L NaOH溶液475 mL和0.40 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:

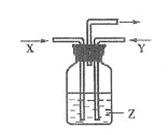
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液需用到的玻璃仪器除上述列出的仪器和玻璃棒外,还需要用到的玻璃仪器是 (填仪器名称)。
(2)下列操作中,容量瓶所不具备的功能有 (填序号)。
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若定容时俯视视刻度线,则所得溶液浓度 0.8 mol/L(填“大于”、“等于”或“小于”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度 0.8 mol/L。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL量筒,应选用 mL量筒最好。

(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液需用到的玻璃仪器除上述列出的仪器和玻璃棒外,还需要用到的玻璃仪器是 (填仪器名称)。
(2)下列操作中,容量瓶所不具备的功能有 (填序号)。
| A.配制一定体积准确浓度的标准溶液 |
| B.量取一定体积的液体 |
| C.测量容量瓶规格以下的任意体积的液体 |
| D.准确稀释某一浓度的溶液 |
(3)根据计算用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若定容时俯视视刻度线,则所得溶液浓度 0.8 mol/L(填“大于”、“等于”或“小于”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度 0.8 mol/L。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL量筒,应选用 mL量筒最好。
(11分)(1)A、C(2分)烧杯(1分)(2)C、E、(2分)
(3)16.0 (1分)大于(1分)等于(1分)(4)10.9(2分)15(1分)
(3)16.0 (1分)大于(1分)等于(1分)(4)10.9(2分)15(1分)
考查一定物质的量浓度溶液的配制及有关误差分析。
(1)根据仪器的结构可知,A是圆底烧瓶,C是分液漏斗,二者不需要。由于物质的溶解和稀释都是在烧杯中进行的,所以还缺少烧杯。
(2)考查容量瓶的应用。由于容量瓶上只有1条刻度线,所以不能测量容量瓶规格以下的任意体积的液体;另外容量瓶不能用来加热溶解固体溶质,所以选项CE是容量瓶所不能具备的,其余都是可以的,答案选CE。
(3)由于容量瓶的规格没有475ml的,所以应该配制500ml,则需要氢氧化钠的质量是0.5L×0.8mol/L×40g/mol=16.0g;根据c=n/V可知,若定容时俯视视刻度线,则容量瓶中溶液的体积减少,浓度偏高;若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度不受影响。
(4)硫酸的物质的量是0.4mol/L×0.5L=0.2mol,所以需要浓硫酸的体积是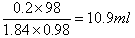 ,根据规格可知,应该选择15ml量筒。
,根据规格可知,应该选择15ml量筒。
(1)根据仪器的结构可知,A是圆底烧瓶,C是分液漏斗,二者不需要。由于物质的溶解和稀释都是在烧杯中进行的,所以还缺少烧杯。
(2)考查容量瓶的应用。由于容量瓶上只有1条刻度线,所以不能测量容量瓶规格以下的任意体积的液体;另外容量瓶不能用来加热溶解固体溶质,所以选项CE是容量瓶所不能具备的,其余都是可以的,答案选CE。
(3)由于容量瓶的规格没有475ml的,所以应该配制500ml,则需要氢氧化钠的质量是0.5L×0.8mol/L×40g/mol=16.0g;根据c=n/V可知,若定容时俯视视刻度线,则容量瓶中溶液的体积减少,浓度偏高;若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度不受影响。
(4)硫酸的物质的量是0.4mol/L×0.5L=0.2mol,所以需要浓硫酸的体积是
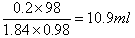 ,根据规格可知,应该选择15ml量筒。
,根据规格可知,应该选择15ml量筒。
练习册系列答案
相关题目