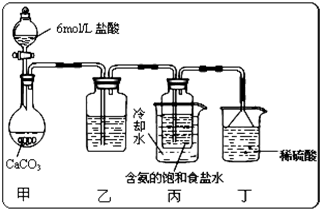
题目内容
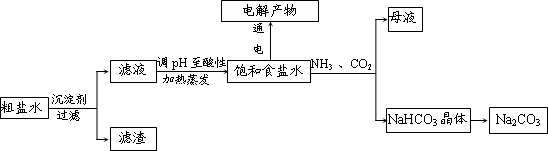
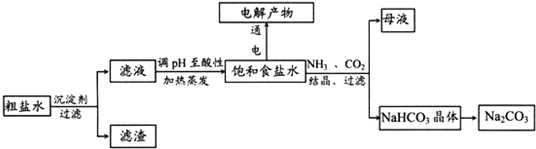
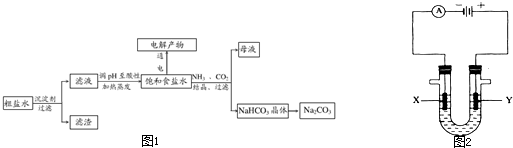
以食盐为原料进行生产并综合利用的某些过程如下图所示.

(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填序号)
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是
(3)电解饱和食盐水反应的离子方程式是
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是
(5)纯碱在生产生活中有广泛的应用.
①纯碱可用于除灶台油污.其原因是(结合离子方程式表述)
②常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13.则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是
③工业上,可以用纯碱代替烧碱生产某些化工产品.如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是

(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填序号)
cab或者cba或者bca
cab或者cba或者bca
.a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是
CO32-和OH-
CO32-和OH-
.(3)电解饱和食盐水反应的离子方程式是
2Cl-+2H2O
2OH-+H2↑+Cl2↑
| ||
2Cl-+2H2O
2OH-+H2↑+Cl2↑
.
| ||
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是
NH3
NH3
.(5)纯碱在生产生活中有广泛的应用.
①纯碱可用于除灶台油污.其原因是(结合离子方程式表述)
Na2CO3溶液显碱性,即CO32-+H2O HCO3-+OH-,与油污发生反应,达到去污目的
HCO3-+OH-,与油污发生反应,达到去污目的
 HCO3-+OH-,与油污发生反应,达到去污目的
HCO3-+OH-,与油污发生反应,达到去污目的Na2CO3溶液显碱性,即CO32-+H2O HCO3-+OH-,与油污发生反应,达到去污目的
HCO3-+OH-,与油污发生反应,达到去污目的
. HCO3-+OH-,与油污发生反应,达到去污目的
HCO3-+OH-,与油污发生反应,达到去污目的②常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13.则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是
1×1010
1×1010
.③工业上,可以用纯碱代替烧碱生产某些化工产品.如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是
2CO32-+Cl2 +H2O=Cl-+ClO-+2HCO3-
2CO32-+Cl2 +H2O=Cl-+ClO-+2HCO3-
.(已知碳酸的酸性强于次氯酸).分析:(1)根据镁离子会与氢氧根离子和碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀;
(2)加入盐酸可以除去过量的碳酸钠和氢氧化钠等进行分析;
(3)电解饱和食盐水生成氢氧化纳、氢气和氯气;
(4)根据发生的反应和流程图中可循环使用的物质种类回答;
(5)①根据纯碱的性质来分析原因;
②氢氧化钠中氢氧根离子是完全是水电离出的,碳酸钠溶液中氢氧根离子是水完全电离生成的,结合离子积计算判断;
③根据纯碱的性质来分析原因及书写化学方程式.
(2)加入盐酸可以除去过量的碳酸钠和氢氧化钠等进行分析;
(3)电解饱和食盐水生成氢氧化纳、氢气和氯气;
(4)根据发生的反应和流程图中可循环使用的物质种类回答;
(5)①根据纯碱的性质来分析原因;
②氢氧化钠中氢氧根离子是完全是水电离出的,碳酸钠溶液中氢氧根离子是水完全电离生成的,结合离子积计算判断;
③根据纯碱的性质来分析原因及书写化学方程式.
解答:解:(1)总体思路是先沉淀再过滤,沉淀时要先加BaCl2溶液,再加Na2CO3溶液,因为碳酸钠能把过量的氯化钡沉淀出来,氢氧化钠可放在它们前面,也可放在它们后面或中间,都完全沉淀完后再过滤;
故答案为:cab或者cba或者bca;
(2)加入适量盐酸pH调至酸性除去的离子是CO32-和OH-,故答案为:CO32-和OH-;
(3)电解饱和食盐水制取氯气的反应为2NaCl+2H2O
2NaOH+H2↑+Cl2↑,该反应中NaCl与NaOH完全电离,则该反应的离子反应为2Cl-+2H2O
2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑.
(4)向分离出NaHCO3晶体后的母液中加入过量生石灰,发生的反应有H2O+CaO=Ca(OH)2、Ca(OH)2+2NH4Cl=2NH3↑+2H2O+CaCl2,最终产物为氯化钙、氨气,其中氨气可再利用,
故答案为:NH3;
(5)①纯碱可用于除灶台油污,其原因是Na2CO3溶液显碱性:即CO32-+H2O HCO3-+OH-,与油污发生反应,达到去污目的.
HCO3-+OH-,与油污发生反应,达到去污目的.
故答案为:Na2CO3溶液显碱性,即CO32-+H2O HCO3-+OH-,与油污发生反应,达到去污目的;
HCO3-+OH-,与油污发生反应,达到去污目的;
②pH 为11碳酸钠溶液中[H+]剩余?[OH-]水=10-14;[OH-]水=10-3mol/L,Na2CO3溶液中加入过量石灰乳,反应生成碳酸钙和氢氧化钠,所得溶液pH=13,则此时水电离出的c(OH-)的值是10-13mol/L,所以反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是1×1010,
故答案为:1×1010;
③由烧碱和氢氧化钠反应生成氯化钠、次氯酸钠和水,纯碱溶液呈碱性,饱和纯碱溶液与Cl2反应制生成次氯酸钠、氯化钠和碳酸氢钠,化学方程式为:2Na2CO3+Cl2 +H2O=NaCl+NaClO+2NaHCO3,其反应的离子方程式是
2CO32-+Cl2 +H2O=Cl-+ClO-+2HCO3-,
故答案为:2CO32-+Cl2 +H2O=Cl-+ClO-+2HCO3-.
故答案为:cab或者cba或者bca;
(2)加入适量盐酸pH调至酸性除去的离子是CO32-和OH-,故答案为:CO32-和OH-;
(3)电解饱和食盐水制取氯气的反应为2NaCl+2H2O
| ||
| ||
故答案为:2Cl-+2H2O
| ||
(4)向分离出NaHCO3晶体后的母液中加入过量生石灰,发生的反应有H2O+CaO=Ca(OH)2、Ca(OH)2+2NH4Cl=2NH3↑+2H2O+CaCl2,最终产物为氯化钙、氨气,其中氨气可再利用,
故答案为:NH3;
(5)①纯碱可用于除灶台油污,其原因是Na2CO3溶液显碱性:即CO32-+H2O
 HCO3-+OH-,与油污发生反应,达到去污目的.
HCO3-+OH-,与油污发生反应,达到去污目的.故答案为:Na2CO3溶液显碱性,即CO32-+H2O
 HCO3-+OH-,与油污发生反应,达到去污目的;
HCO3-+OH-,与油污发生反应,达到去污目的;②pH 为11碳酸钠溶液中[H+]剩余?[OH-]水=10-14;[OH-]水=10-3mol/L,Na2CO3溶液中加入过量石灰乳,反应生成碳酸钙和氢氧化钠,所得溶液pH=13,则此时水电离出的c(OH-)的值是10-13mol/L,所以反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是1×1010,
故答案为:1×1010;
③由烧碱和氢氧化钠反应生成氯化钠、次氯酸钠和水,纯碱溶液呈碱性,饱和纯碱溶液与Cl2反应制生成次氯酸钠、氯化钠和碳酸氢钠,化学方程式为:2Na2CO3+Cl2 +H2O=NaCl+NaClO+2NaHCO3,其反应的离子方程式是
2CO32-+Cl2 +H2O=Cl-+ClO-+2HCO3-,
故答案为:2CO32-+Cl2 +H2O=Cl-+ClO-+2HCO3-.
点评:本题是一道实验探究综合题,充分的展示了化学知识的方方面面,该题综合性强难度较大,对训练学生良好地思维品质以及知识的严密性有较好的帮助.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目