题目内容
4.在下列物质的溶液中滴入AgNO3溶液,产生淡黄色沉淀,加入稀HNO3后沉淀不消失的是( )| A. | NaCl | B. | NaBr | C. | KI | D. | K2CO3 |
分析 AgX为不溶于硝酸的沉淀,AgF除外,碳酸银可溶于硝酸,只有AgBr为淡黄色沉淀,以此来解答.
解答 解:A.NaCl溶液中滴入AgNO3溶液,产生白色沉淀,故A不选;
B.NaBr溶液中滴入AgNO3溶液,产生淡黄色沉淀,加入稀HNO3后沉淀不消失,故B选;
C.KI溶液中滴入AgNO3溶液,产生黄色沉淀,加入稀HNO3后沉淀不消失,故C不选;
D.K2CO3溶液中滴入AgNO3溶液,产生白色沉淀,加入稀HNO3后沉淀消失,故D不选;
故选B.
点评 本题考查常见离子的性质,为高频考点,把握离子之间的反应、反应现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.根据表中7种短周期元素的有关信息判断,下列说法错误的是( )
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.099 | 0.102 | 0.143 | 0.152 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -1 | -2 | +3 | +1 |
| A. | 元素④气态氢化物的稳定性大于元素⑤气态氢化物的稳定性 | |
| B. | 元素②氢化物的沸点小于元素⑤氢化物的沸点 | |
| C. | 元素②⑥形成的化合物具有两性 | |
| D. | ⑦①可形成离子化合物 |
12.有如下合成路线,甲经二步转化为丙:

下列叙述错误的是( )

下列叙述错误的是( )
| A. | 步骤(2)产物中可能含有未反应的甲,可用溴水检验是否含甲 | |
| B. | 反应(1)的无机试剂是液溴,铁作催化剂 | |
| C. | 甲和丙均可与酸性KMnO4溶液发生反应 | |
| D. | 乙属于烃的衍生物,其所含官能团可能为溴原子 |
19.下列化合物中,同分异构体数目超过7个的有( )
| A. | 已烷 | B. | 已烯 | C. | 1,2-二溴丙烷 | D. | 乙酸乙酯 |
9. 常温下,将 Cl2缓缓通入水中至饱和,然后再滴加0.1mol•L-1 NaOH溶液,整个过程中溶液 pH 变化曲线如图所示.下列选项正确的是( )
常温下,将 Cl2缓缓通入水中至饱和,然后再滴加0.1mol•L-1 NaOH溶液,整个过程中溶液 pH 变化曲线如图所示.下列选项正确的是( )
 常温下,将 Cl2缓缓通入水中至饱和,然后再滴加0.1mol•L-1 NaOH溶液,整个过程中溶液 pH 变化曲线如图所示.下列选项正确的是( )
常温下,将 Cl2缓缓通入水中至饱和,然后再滴加0.1mol•L-1 NaOH溶液,整个过程中溶液 pH 变化曲线如图所示.下列选项正确的是( )| A. | a 点所示的溶液中:c(H+ )=c(Cl-)+c(OH-) | |
| B. | b 点所示的溶液中:c(H+ )>c(Cl- )>c(HClO)>c(ClO- ) | |
| C. | c 点所示的溶液中:c(Na+ )=c(HClO)+c(ClO- ) | |
| D. | d 点所示的溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
16.某电池总反应为2Fe 3++Cu=2Fe 2++Cu 2+,不能实现该反应的原电池是( )
| A. | 电极材料Fe、Cu,电解质溶液FeCl3溶液 | |
| B. | 电极材料石墨、Cu,电解质溶液Fe2(SO4)3溶液 | |
| C. | 电极材料Pt、Cu,电解质溶液FeCl3溶液 | |
| D. | 电极材料Ag、Cu,电解质溶液Fe2(SO4)3溶液 |
13.萜品醇可作为消毒剂、抗氧化剂和溶剂,已知α-萜品醇的结构简式如下式,则下列说法错误的是( )
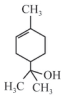

| A. | 1mol该物质最多能和1mol氢气发生加成反应 | |
| B. | 该物质不属于烃 | |
| C. | 该物质能使溴水褪色 | |
| D. | 分子式为C9H16O |

 硫酸工业尾气中二氧化硫易造成环境污染,必须处理.用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其循环再生机理如图所示,
硫酸工业尾气中二氧化硫易造成环境污染,必须处理.用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其循环再生机理如图所示,