题目内容
(10分,每空2分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:

有关离子完全沉淀的pH如下表:

(1)写出Cr2O72—与FeSO4溶液在酸性条件下反应的离子方程式________________________________________________________。
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂为:_____________(填序号);
A.Na2O2 B.Ca(OH)2 C.Ba(OH)2 D.NaOH
此时调节溶液的pH范围在____________(填序号)最佳。
A.12~14 B.10~11 C.6~8 D.3~4
(3)将等体积的4.0×10-3mol·L-1的AgNO3和4.0×10-3mol·L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式(2分),并简要写出能生成Ag2CrO4沉淀原因的计算过程(2分)。
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:

有关离子完全沉淀的pH如下表:

(1)写出Cr2O72—与FeSO4溶液在酸性条件下反应的离子方程式________________________________________________________。
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂为:_____________(填序号);
A.Na2O2 B.Ca(OH)2 C.Ba(OH)2 D.NaOH
此时调节溶液的pH范围在____________(填序号)最佳。
A.12~14 B.10~11 C.6~8 D.3~4
(3)将等体积的4.0×10-3mol·L-1的AgNO3和4.0×10-3mol·L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式(2分),并简要写出能生成Ag2CrO4沉淀原因的计算过程(2分)。
(每空2分,总计10分)
(1)Cr2O72— + 6Fe2+ +14H+ ="=" 2Cr3+ + 6Fe3+ + 7H2O。
(2)B C
(3)Ag2CrO4 (s)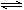 2Ag+(aq) + CrO42—(aq)
2Ag+(aq) + CrO42—(aq)
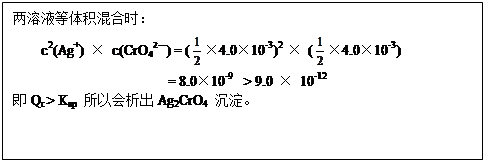
(1)Cr2O72— + 6Fe2+ +14H+ ="=" 2Cr3+ + 6Fe3+ + 7H2O。
(2)B C
(3)Ag2CrO4 (s)
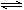 2Ag+(aq) + CrO42—(aq)
2Ag+(aq) + CrO42—(aq)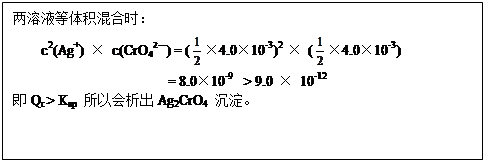
试题分析::(1)二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应,二价铁离子被氧化成三价铁离子,Cr2O72-被还原为Cr3+,反应方程式为Cr2O72-+6Fe2++14H+═2 Cr3++6Fe3++7H2O。
故答案为:Cr2O72-+6Fe2++14H+═2 Cr3++6Fe3++7H2O。
(2)A.Na2O2有强氧化性,能把Cr3+氧化成Cr6+,从而得不到Cr(OH)3,故错误。
B.Ca(OH)2和 D.NaOH使Fe3+和Cr3+产生氢氧化物沉淀,且没有其它沉淀杂质生成,故正确。
C.Ba(OH)2和硫酸根离子能产生硫酸钡沉淀,生成杂质,故错误。
在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀,且没有氢氧化亚铁沉淀,所以溶液的PH应大于5.6小于9,所以B正确。
故答案为:B;C。
点评:本题考查了离子方程式的书写,难度不大,注意题中的图示和表中所提供的信息,分析透彻题中所给出的信息解题的关键。

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目

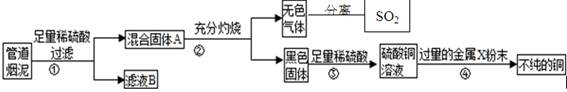

 X+CO2+H2O ;Z+CO2
X+CO2+H2O ;Z+CO2 X+O2 ;Z+H2O
X+O2 ;Z+H2O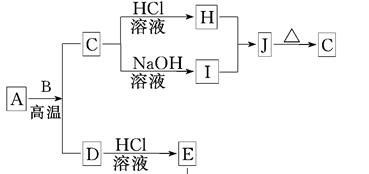
 (提示:4FeS2+11O2
(提示:4FeS2+11O2 2Fe2O3+8SO2)
2Fe2O3+8SO2)