题目内容
9.对于0.1mol•L-1 Na2SO3溶液,下列叙述不正确的是( )| A. | 加水稀释,溶液的pH减小 | B. | c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3) | ||
| C. | c(Na+)+c(H+)=2 c(SO32-)+2c(HSO3-)+c(OH-) | D. | c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) |
分析 A.加水稀释后,亚硫酸钠的电离程度增大,但溶液中氢氧根离子浓度减小,溶液的pH减小;
B.根据亚硫酸钠溶液中的物料守恒判断;
C.根据亚硫酸钠溶液中的电荷守恒判断;
D.亚硫酸根离子部分水解,溶液呈碱性,则c(OH-)>c(H+),由于氢氧根离子来自水的电离和亚硫酸根离子的水解,则c(OH-)>c(HSO3-).
解答 解:A.加水稀释Na2SO3溶液后,溶液中亚硫酸根离子的水解程度增大,但溶液中氢氧根离子浓度减小,溶液的pH减小,故A正确;
B.Na2SO3溶液中存在物料守恒:c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3),故B正确;
C.Na2SO3溶液中存在电荷守恒:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故C错误;
D.Na2SO3溶液中,亚硫酸根离子部分水解,溶液呈碱性,则:(Na+)>c(SO32-)、c(OH-)>c>c(H+),由于氢氧根离子来自水的电离和亚硫酸根离子的水解,则c(OH-)>c(HSO3-),溶液中正确的离子浓度大小为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),故D错误;
故选CD.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及盐的水解原理、电荷守恒、物料守恒等知识,注意掌握盐的水解原理及电荷守恒、物料守恒在判断离子浓度大小中应用方法.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
19.下列说法中不正确的是( )
| A. | 分子式为C5Hl2O并能与金属钠反应放出氢气的有机化合物有6种 | |
| B. | 可以用酸性高锰酸钾溶液区分苯和甲苯 | |
| C. | 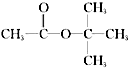 在核磁共振氢谱中能出现两个峰,且其峰面积之比为3:1 在核磁共振氢谱中能出现两个峰,且其峰面积之比为3:1 | |
| D. | 可用氢氧化钠溶液、银氨溶液和碘水检验淀粉溶液是否是部分发生水解 |
20.下列物质中属于共价化合物的是( )
| A. | NH4Cl | B. | O2 | C. | Fe | D. | HNO3 |
17.下列关于物质性质的比较,不正确的是( )
| A. | 金属性由强到弱:Na>Mg>Al | |
| B. | 离子半径由大到小:Na+>S2->O2- | |
| C. | 离子的还原性由强到弱:S2->Cl->F- | |
| D. | 酸性由强到弱:HClO4>HBrO4>HIO4 |
4.下列不能用勒夏特列原理解释的是( )
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | FeCl3溶液的配制需先将固体FeCl3溶解在盐酸中,再加水稀释到相应浓度 |
14.合金是一类用途广泛的金属材料.下列物质不属于合金的是( )
| A. | 黄金 | B. | 青铜 | C. | 钢铁 | D. | 不锈钢 |
1.某学生实验小组做金属钠与浓盐酸反应实验,发现反应平稳,无火星,有白雾,有大量的白色小颗粒向下坠落.对上述实验现象分析不正确的是( )
| A. | 钠在浓盐酸中反应速率比在水中小 | |
| B. | 浓盐酸中c(H+)比稀盐酸中小 | |
| C. | 浓盐酸挥发出大量白雾,使产生的H2无法燃烧和爆炸 | |
| D. | 生成的固体NaCl使反应速率降低 |
19.下列金属的冶炼方法与钠相同的是( )
| A. | 铁 | B. | 铜 | C. | 银 | D. | 铝 |