题目内容
(2011?河西区一模)海洋植物如海带、海藻中含有丰富的碘元素,经灼烧后灰烬中的碘以碘离子形式存在.某实验小组同学为了验证海带中含有碘.从中提取碘并计算海带中的含碘量,设计了以下实验:
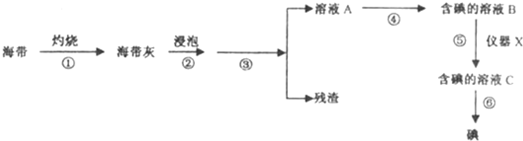
(1)在进行步骤①之前,他们称取完a g干海带,甲同学提出将海带先剪碎.然后用水洗净放入坩埚中.再灼烧至海带完全成灰烬.而乙同学认为甲的操作建议不合理,其理由是
(2)将冷却的海带灰转移至小烧杯,步骤②用来浸泡海带灰的试剂是
(3)接下来步骤③涉及的一系列操作名称是
(4)步骤④中甲同学向溶液A中先滴加几滴淀粉溶液,未发现明显变化,再滴加适量的稀硫酸发现溶液颜色变蓝,请写出此反应的离子方程式:
A.浓硫酸 B.新制氯水 C.KMnO4溶液 D.H2O2溶液
(5)在步焉⑤提取碘的过程中.甲同学将溶液B放入仪器x中,再向其中加入一定量的试剂Y,振荡,静置.写出仪器X的名称
(6)步骤⑥从溶液C中提取碘并回收试剂Y的操作方法是
.

(1)在进行步骤①之前,他们称取完a g干海带,甲同学提出将海带先剪碎.然后用水洗净放入坩埚中.再灼烧至海带完全成灰烬.而乙同学认为甲的操作建议不合理,其理由是
用水洗净时,碘化物充分溶解在水中,会使得海带中的一些碘元素减少
用水洗净时,碘化物充分溶解在水中,会使得海带中的一些碘元素减少
.(2)将冷却的海带灰转移至小烧杯,步骤②用来浸泡海带灰的试剂是
蒸馏水
蒸馏水
.(3)接下来步骤③涉及的一系列操作名称是
过滤
过滤
.(4)步骤④中甲同学向溶液A中先滴加几滴淀粉溶液,未发现明显变化,再滴加适量的稀硫酸发现溶液颜色变蓝,请写出此反应的离子方程式:
H2O2+2H++2I-=2H2O+I2
H2O2+2H++2I-=2H2O+I2
.乙同学观察完甲同学的实验后,为了使I-反应得更完全,他建议最好选用的氧化剂是D
D
.A.浓硫酸 B.新制氯水 C.KMnO4溶液 D.H2O2溶液
(5)在步焉⑤提取碘的过程中.甲同学将溶液B放入仪器x中,再向其中加入一定量的试剂Y,振荡,静置.写出仪器X的名称
分液漏斗
分液漏斗
.(6)步骤⑥从溶液C中提取碘并回收试剂Y的操作方法是
蒸馏
蒸馏
.若提取得到bg碘,则此海带中含碘元素的质量分数是| b |
| a |
| b |
| a |
分析:(1)根据用水浸泡一段时间,碘化物充分溶解在水中;
(2)将海带灰放在蒸馏水中浸泡,可以将溶于水的部分和难溶物质分离;
(3)分离固体和液体的操作是过滤;
(4)具有氧化性的物质可以将碘离子氧化为单质碘,双氧是绿色氧化剂;
(5)实现萃取操作的仪器可以选择分液漏斗;
(6)碘和有机物的分离可以采用蒸馏法,根据元素守恒来计算碘元素的质量分数.
(2)将海带灰放在蒸馏水中浸泡,可以将溶于水的部分和难溶物质分离;
(3)分离固体和液体的操作是过滤;
(4)具有氧化性的物质可以将碘离子氧化为单质碘,双氧是绿色氧化剂;
(5)实现萃取操作的仪器可以选择分液漏斗;
(6)碘和有机物的分离可以采用蒸馏法,根据元素守恒来计算碘元素的质量分数.
解答:解:(1)将海带先剪碎.然后用水洗净放入坩埚中时,由于用水浸泡一段时间,这样碘化物充分溶解在水中,使得碘元素的含量减少,
故答案为:用水洗净时,碘化物充分溶解在水中,会使得海带中的一些碘元素减少;
(2)将海带灰放在蒸馏水中浸泡,故答案为:蒸馏水;
(3)分离难溶性的固体和可溶性的含有碘元素的液体的操作是过滤,故答案为:过滤;
(4)具有氧化性的物质可以将碘离子氧化为单质碘,双氧是绿色氧化剂,在酸性环境下,氧化碘离子的实质是:H2O2+2H++2I-=2H2O+I2,还原产物是水,不会产生杂质,
故答案为:H2O2+2H++2I-=2H2O+I2;D;
(5)实现萃取操作的仪器可以选择分液漏斗,故答案为:分液漏斗;
(6)碘和有机物的分离可以采用蒸馏法,若提取得到bg碘,则碘元素碘元素的质量分数
×100%,故答案为:
.
故答案为:用水洗净时,碘化物充分溶解在水中,会使得海带中的一些碘元素减少;
(2)将海带灰放在蒸馏水中浸泡,故答案为:蒸馏水;
(3)分离难溶性的固体和可溶性的含有碘元素的液体的操作是过滤,故答案为:过滤;
(4)具有氧化性的物质可以将碘离子氧化为单质碘,双氧是绿色氧化剂,在酸性环境下,氧化碘离子的实质是:H2O2+2H++2I-=2H2O+I2,还原产物是水,不会产生杂质,
故答案为:H2O2+2H++2I-=2H2O+I2;D;
(5)实现萃取操作的仪器可以选择分液漏斗,故答案为:分液漏斗;
(6)碘和有机物的分离可以采用蒸馏法,若提取得到bg碘,则碘元素碘元素的质量分数
| b |
| a |
| b |
| a |
点评:本题考查了物质的分离和提纯,难度不大,学习中注意掌握萃取的操作.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
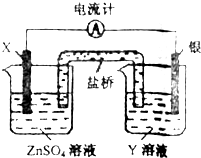 (2011?河西区一模)依据氧化还原反应:2Ag+(aq)+Zn(s)=2Ag(s)+Zn2+(aq)设计的原电池如图所示.下列叙述正确的是( )
(2011?河西区一模)依据氧化还原反应:2Ag+(aq)+Zn(s)=2Ag(s)+Zn2+(aq)设计的原电池如图所示.下列叙述正确的是( )