题目内容
0.7g铁粉放入40mL 1mol/L的稀硝酸中,反应停止后溶液中的盐是
- A.只有Fe(NO3)3
- B.只有Fe(NO3)2
- C.Fe(NO3)3和Fe(NO3)2
- D.不能确定
C
分析:根据硝酸和金属铁的反应原理:Fe+4HNO3=Fe(NO3)3+2H2O+NO↑,如果金属铁过量时,铁会和三价铁继续反应生成亚铁离子,即Fe+2Fe(NO3)3=3Fe(NO3)2根据方程式计算即可.
解答:0.7g金属铁的物质的量为: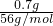 =0.0125mol,Fe+4HNO3=Fe(NO3)3+2H2O+NO↑,
=0.0125mol,Fe+4HNO3=Fe(NO3)3+2H2O+NO↑,
硝酸的物质的量为0.04L×1mol/L=0.04mol,其中被还原的硝酸化合价降低,0.04mol中只有0.01mol,
质量是:0.01mol×63g/mol=0.63g,
根据方程式,0.04mol硝酸消耗铁单质0.01mol,所以铁粉剩余0.0125-0.01=0.0025mol;生成硝酸铁0.01mol,
Fe+2Fe(NO3)3═3Fe(NO3)2,所以0.0025mol铁粉消耗0.005mol硝酸铁,生成0.0075mol硝酸亚铁,
质量为:0.0075mol×180g/mol=1.35g,还剩0.01-0.005mol=0.005mol硝酸铁,
质量为:0.005mol×242g/mol=1.21g,
所以,生成的硝酸盐中有0.005mol硝酸铁(质量为1.21g),0.0075mol硝酸亚铁(质量为1.35g).
故选C.
点评:本题考查学生金属铁和硝酸的反应情况,注意铁的量的多少对反应的影响,难度较大.
分析:根据硝酸和金属铁的反应原理:Fe+4HNO3=Fe(NO3)3+2H2O+NO↑,如果金属铁过量时,铁会和三价铁继续反应生成亚铁离子,即Fe+2Fe(NO3)3=3Fe(NO3)2根据方程式计算即可.
解答:0.7g金属铁的物质的量为:
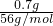 =0.0125mol,Fe+4HNO3=Fe(NO3)3+2H2O+NO↑,
=0.0125mol,Fe+4HNO3=Fe(NO3)3+2H2O+NO↑,硝酸的物质的量为0.04L×1mol/L=0.04mol,其中被还原的硝酸化合价降低,0.04mol中只有0.01mol,
质量是:0.01mol×63g/mol=0.63g,
根据方程式,0.04mol硝酸消耗铁单质0.01mol,所以铁粉剩余0.0125-0.01=0.0025mol;生成硝酸铁0.01mol,
Fe+2Fe(NO3)3═3Fe(NO3)2,所以0.0025mol铁粉消耗0.005mol硝酸铁,生成0.0075mol硝酸亚铁,
质量为:0.0075mol×180g/mol=1.35g,还剩0.01-0.005mol=0.005mol硝酸铁,
质量为:0.005mol×242g/mol=1.21g,
所以,生成的硝酸盐中有0.005mol硝酸铁(质量为1.21g),0.0075mol硝酸亚铁(质量为1.35g).
故选C.
点评:本题考查学生金属铁和硝酸的反应情况,注意铁的量的多少对反应的影响,难度较大.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目