题目内容
氯化钠是一种重要的生活、生产必需品。下列表述中正确的是( )
A.NaCl的电子式为 |
| B.NaCl的水溶液是强电解质 |
| C.23Na37Cl中质子数和中子数之比是8:7 |
| D.电解熔融氯化钠可得到氯气和金属钠 |
D
解析试题分析:A、NaCl为离子化合物,电子式中氯离子漏掉方括号,错误;B、NaCl的水溶液是混合物,既不是电解质,也不是非电解质,错误;C.23Na37Cl中质子数为28,中子数为32,二者之比是7:8,错误;D、电解熔融氯化钠可得到氯气和金属钠,正确。
考点:考查原子构成、分子结构、电解质的概念及金属钠的冶炼。

练习册系列答案
相关题目
下列说法正确的是( )
| A.镁与极稀硝酸反应生成硝酸铵的离子方程式为:4Mg+6H++NO3-=4Mg2++NH4++3H2O |
| B.将10mL 0.1 mol/L Na2CO3溶液逐滴滴加到10 mL 0.1 mol/L盐酸中,c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) |
| C.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=2c(Ba2+) |
| D.将10mL 0.1 mol.L-1 KAl(SO4)2溶液和10 mL 0.2 mol.L-1 Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2 |
下列离子方程式不正确的是 


| A.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
B.在亚硫酸中加入过量的次氯酸钠溶液:H2SO3+ClO-=Cl-+2H++SO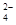 |
| C.在碳酸氢镁溶液中加入过量氢氧化钠溶液: Mg2++2HCO 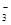 +4OH-=Mg(OH)2 ↓+2CO +4OH-=Mg(OH)2 ↓+2CO +2H2O +2H2O |
| D.在过氧化钠中加入稀硫酸:2Na2O2+4H+=4Na++2H2O+O2↑ |
下列各组离子在指定的溶液中能大量共存的是
| A.在pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
| B.能溶解Al(OH)3的溶液中:NH4+、SO42-、Cl-、HCO3- |
| C.酚酞呈红色的溶液中:K+、Na+、AlO2-、NO3- |
| D.含有大量Fe2+的溶液中:H+、K+、ClO-、SO42- |
下列离子方程式书写正确的是( )
| A.少量CO2通入Ba(OH)2溶液中:CO2+2OH—= CO32— +H2O |
| B.NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42—恰好沉淀完全 NH4++Al3++2SO42—+2Ba2++4OH—= NH3·H2O+Al(OH)3↓+2BaSO4↓ |
| C.FeCl3溶液腐蚀铜线路板:Fe3++Cu = Fe2++Cu2+ |
| D.向NaHCO3溶液中滴入少量Ca(OH)2溶液:HCO3—+OH—= CO32—+H2O |
下列离子方程式书写正确的是
| A.钠与水反应:Na+H2O=Na++OH-+H2↑ |
| B.硫酸铜溶液与氢氧化钡溶液反应:Ba2+ + SO42- =BaSO4↓ |
| C.氨水和硫酸铝溶液反应:3OH-+ Al3+ =Al(OH)3↓ |
| D.二氧化硅与氢氧化钠溶液反应 SiO2+2OH-=SiO32-+H2O |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.1.0 mol/L的NaHSO4溶液:K+、Fe2+、NO3-、Cl- |
| B.l.0 mol·L-1 NaClO溶液:Fe2+、K+、I一、Cl- |
| C.甲基橙显黄色的溶液: Na+、CO32-、NO3-、SO32- |
| D.在c(H+)/c(OH-) = 1×1013的溶液:NH4+、Ca2+、C1-、K+ |
下列有关溶液组成的描述合理的是
| A.无色溶液中可能大量存在Al3+、NH4+、Cl?、S2? |
| B.酸性溶液中可能大量存在Na+、ClO?、SO42?、I? |
| C.弱碱性溶液中可能大量存在Na+、K+、Cl?、HCO3? |
| D.中性溶液中可能大量存在Fe3+、K+、Cl?、SO42? |
已知氧化性:HClO>Cl2>Fe3+>SO42-;常温下,电离常数:K(H2CO3)>K(HClO)>K(HCO3-)>KAl(OH)3;则下列相关离子方程式正确的是
| A.0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+ClO-=SO42-+Cl-+H+ |
| B.小苏打溶液与偏铝酸钠溶液混合:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32- |
| C.“84”消毒液(主要成分为NaClO)露置在空气中变质:2ClO-+CO2+H2O=CO32-+2HClO |
| D.在“84”消毒液中滴加FeSO4溶液:2Fe2++ClO-+H2O=2Fe3++Cl-+2OH- |