题目内容
氯化钠溶液在生产、生活中都有广泛的用途.现配置1L 0.2mol?L-1NaCl溶液.请回答问题.
| 实验步骤 | 有关问题 |
| (1)计算并称量 | 需要NaCl的质量为______ g |
| (2)溶解 | 为加速溶解,可进行的操作是______ |
(3)转移 | 指出示意图中的两处错误: 错误1:______ 错误2:______ |
| (4)定容 | 若俯视容量瓶刻度线,定容后会造成所配溶液的物质的量浓度______(填“偏高”“偏低”或“无影响”) |
(1)m=nM=CVM=0.2mol?L-1×1L×58.5g/mol=11.7 g.
故答案为:11.7.
(2)玻璃棒的作用有搅拌和引流,为加速溶解可用玻璃棒搅拌.
故答案为:用玻璃棒搅拌.
(3)转移溶液要用玻璃棒引流;配制1L溶液要用1000mL容量瓶.
故答案为:向容量瓶中转移溶液时未用玻璃棒引流;容量瓶容积与所配溶液体积不匹配.
(4)定容观察液面时俯视,溶液体积偏小,浓度偏高.
故答案为:偏高.
分析:(1)根据m=nM=CVM计算氯化钠的质量.
(2)根据玻璃棒的作用分析.
(3)转移溶液要用玻璃棒引流;配制1L溶液要用1000mL容量瓶.
(4)根据c= 分析操作对溶质的物质的量或对溶液的体积的影响判断;
分析操作对溶质的物质的量或对溶液的体积的影响判断;
点评:本题考查了一定物质的量浓度溶液的配制,难度不大,注意实验的基本操作方法和注意事项.
故答案为:11.7.
(2)玻璃棒的作用有搅拌和引流,为加速溶解可用玻璃棒搅拌.
故答案为:用玻璃棒搅拌.
(3)转移溶液要用玻璃棒引流;配制1L溶液要用1000mL容量瓶.
故答案为:向容量瓶中转移溶液时未用玻璃棒引流;容量瓶容积与所配溶液体积不匹配.
(4)定容观察液面时俯视,溶液体积偏小,浓度偏高.
故答案为:偏高.
分析:(1)根据m=nM=CVM计算氯化钠的质量.
(2)根据玻璃棒的作用分析.
(3)转移溶液要用玻璃棒引流;配制1L溶液要用1000mL容量瓶.
(4)根据c=
 分析操作对溶质的物质的量或对溶液的体积的影响判断;
分析操作对溶质的物质的量或对溶液的体积的影响判断;点评:本题考查了一定物质的量浓度溶液的配制,难度不大,注意实验的基本操作方法和注意事项.

练习册系列答案
相关题目
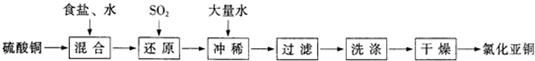


 CuCl↓+Cl-.
CuCl↓+Cl-.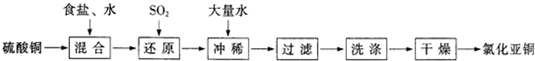
 Na2CO3+CO2↑+H2O。某课外兴趣小组同学,按照“侯氏制碱法”原理,设计了如图所示的一套实验装置:
Na2CO3+CO2↑+H2O。某课外兴趣小组同学,按照“侯氏制碱法”原理,设计了如图所示的一套实验装置: 