题目内容
下列事实与氢键有关的是
| A.HF、HCl、HBr、HI的热稳定性依次减弱 |
| B.水加热到很高的温度都难以分解 |
| C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
| D.水结成冰体积膨胀 |
D
解析试题分析:A、它们都是通过共价键结合,元素的非金属性越强,其氢化物就越稳定,由于非金属性F>Cl>Br>I,所以稳定性HF、HCl、HBr、HI的热稳定性依次减弱。但是这与氢键无关。错误。B、水加热到很高的温度都难以分解,是因为在水分子内的H—O键的键能大,与氢键无关。错误。C、CH4、SiH4、GeH4、SnH4都是由分子构成的物质。结构相似。物质的相对分子质量越大,分子间作用力就越大,克服分子间作用力使物质熔化消耗的能量就越高。即熔点随相对分子质量增大而升高。但是与氢键无关。错误。D、水结成冰,在物质内分子的排列由无序变为有序,在水分子之间存在氢键。分子之间的间隔增大,体积膨胀。也正是这种作用力,增加例如水中溶解氧气量。使水中的植物和动物都可以存活。正确。
考查:物质的性质与氢键的关系的知识。

练习册系列答案
相关题目
下列叙述正确的是
| A.非金属原子间以共价键结合的物质一定是共价化合物 |
| B.含有共价键的化合物一定是共价化合物 |
| C.凡是能电离出离子的化合物一定是离子化合物 |
| D.凡是含有离子键的化合物一定是离子化合物 |
PH3是一种无色剧毒气体,其分子结构和NH3相似。下列判断错误的是( )
| A.PH3分子呈三角锥形 |
| B.PH3分子是极性分子 |
| C.PH3分子中所有原子最外层都满足8e—结构 |
| D.PH3分子稳定性低于NH3分子,因为N-H键键长更短、键能更高 |
下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是
| A.液溴和苯分别受热变为气体 | B.干冰和氯化铵分别受热变为气体 |
| C.二氧化硅和铁分别受热熔化 | D.食盐和葡萄糖分别溶解在水中 |
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示)。已知该分子中N—N—N键角都是108.1°,下列有关N(NO2)3的说法正确的是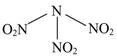
| A.分子中N、O间形成的共价键是非极性键 | B.分子中四个氮原子共平面 |
| C.该物质既有氧化性又有还原性 | D.15.2 g该物质含有6.02×1022个原子 |
下列说法中不正确的是
| A.含有离子键的化合物一定是离子化合物 |
| B.活泼的金属和活泼的非金属原子之间形成的化学键一定是离子键 |
| C.共价化合物中不可能存在离子键 |
| D.某元素原子最外层只有1个电子,它跟卤素可能形成离子键也可能形成共价键 |
下列电子式中,正确的是
A. | B. | C. | D. |
下列关于化学键的叙述,正确的一项是( )
| A.离子化合物中一定含有离子键 |
| B.单质分子中均不存在化学键 |
| C.含有极性键的分子一定是极性分子 |
| D.含有共价键的化合物一定是共价化合 |
(双选)下列电子式有误的是( )。
A.氯原子∶ · · | B.硫离子 | C.溴离子[∶Br∶]- | D.钙离子Ca2+ |