题目内容
把2.72 g铁、铝混合物溶于200 mL 5mol?L-1氢氧化钠溶液中,反应后氢氧化钠的浓度变为4.6mol?L-1 (溶液体积变化忽略不计).求:(1)反应中消耗氢氧化钠的物质的量.
(2)计算该混合物中铁、铝的物质的量..
【答案】分析:发生反应为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,根据氢氧化钠的物质的量的变化量可知反应的Al的物质的量进而计算该混合物中铁的物质的量.
解答:解:(1)反应前氢氧化钠溶液中NaOH的物质的量为:0.2L×5mol/L=1mol,
反应后氢氧化钠溶液中NaOH的物质的量为:0.2L×4.6mol/L=0.92mol,
则消耗的消耗氢氧化钠的物质的量为:1mol-0.92mol=0.08mol,
答:反应中消耗氢氧化钠的物质的量为0.08mol;
(2)发生反应为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
设混合物中含有xmolFe,ymolAl,
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 2
ymol 0.08mol
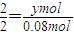 ,解之得y=0.08,
,解之得y=0.08,
根据质量守恒,则
0.08mol×27g/mol+xmol×56g/mol=2.72g,
解得x=0.01,
答:该混合物中铁、铝的物质的量分别是0.01mol、0.08mol.
点评:本题考查化学方程式的计算,题目难度不大,注意只有铝与氢氧化钠溶液反应,根据质量守恒计算.
解答:解:(1)反应前氢氧化钠溶液中NaOH的物质的量为:0.2L×5mol/L=1mol,
反应后氢氧化钠溶液中NaOH的物质的量为:0.2L×4.6mol/L=0.92mol,
则消耗的消耗氢氧化钠的物质的量为:1mol-0.92mol=0.08mol,
答:反应中消耗氢氧化钠的物质的量为0.08mol;
(2)发生反应为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
设混合物中含有xmolFe,ymolAl,
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 2
ymol 0.08mol
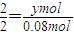 ,解之得y=0.08,
,解之得y=0.08,根据质量守恒,则
0.08mol×27g/mol+xmol×56g/mol=2.72g,
解得x=0.01,
答:该混合物中铁、铝的物质的量分别是0.01mol、0.08mol.
点评:本题考查化学方程式的计算,题目难度不大,注意只有铝与氢氧化钠溶液反应,根据质量守恒计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目