题目内容
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
次要:Cu2++CO32-=CuCO3↓(几乎不发生反应。下同)
(2)CuSO4+Na2S
主要:Cu2++S2-=CuS↓
次要:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
则下列几种物质的溶解度大小的比较中,正确的是( )
| A.CuS<Cu(OH)2<CuCO3 |
| B.CuS>Cu(OH)2>CuCO3 |
| C.Cu(OH)2>CuCO3>CuS |
| D.Cu(OH)2<CuCO3<CuS |
A
解析

练习册系列答案
相关题目
咖喱是一种烹饪辅料,白色衬衣被咖喱汁玷污后,用普通肥皂洗涤,发现黄色污渍变成红色,经水漂洗后红色又变成黄色。与咖喱汁具有上述相似化学原理的试剂有( )
| A.石蕊试液 | B.品红试液 | C.氯水 | D.淀粉KI(aq) |
下图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )
| A.两条曲线间任意点均有c(H+)×c(OH-)=KW |
| B.M区域内任意点均有c(H+)<c(OH-) |
| C.图中T1<T2 |
| D.XZ线上任意点均有pH=7 |
常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,正确的是( )
| A.HA可能为一元弱酸 |
| B.MOH为一元强碱 |
| C.N点水的电离程度小于K点水的电离程度 |
| D.若K点对应的溶液的pH=10,则有c(MOH)+c(M+)="0.01" mol·L-1 |
已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4溶液显酸性,关于NaHC2O4溶液中离子浓度关系的叙述不正确的是( )
| A.c(Na+)>c(HC2O4—)>c(C2O42—)>c(H2C2O4) |
| B.c(Na+)=c(HC2O4—)+c(C2O42—)+c(H2C2O4) |
| C.c(Na+)+c(H+)=c(HC2O4—)+c(C2O42—)+c(OH-) |
| D.c(H+)+c(H2C2O4)=c(C2O42—)+c(OH-) |
下表列出了几种常见物质的电离常数或溶度积:
在一定量的0.2 mol/L CaCl2溶液中加入等体积的下列溶液,可以产生沉淀的是( )
| A.由水电离出的c(H+)=10-9 mol/L的HF溶液 |
| B.pH=10的氨水 |
| C.1 mol/L的NaHCO3溶液 |
| D.10-9 mol/L的AgNO3溶液 |
对于0.1 mol·L-1 Na2SO3溶液,正确的是( )
| A.升高温度,溶液的pH降低 |
| B.c(Na+)=2c(SO32―)+c(HSO3-)+c(H2SO3) |
| C.c(Na+)+c(H+)=2c(SO32―)+2c(HSO3-)+c(OH―) |
| D.加入少量NaOH固体,c(SO32―)与c(Na+)均增大 |
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A.溶液中导电粒子的数目减少 |
B.溶液中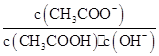 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH=7 |
下列有关说法正确的是( )
| A.常温下,0.1 mol/L NH4Cl溶液加蒸馏水稀释,溶液的pH不断增大,但无限接近7 |
| B.25 ℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
| C.pH=6的纯水中,c(OH-)=10-8 mol·L-1 |
| D.稀释0.01 mol·L-1的醋酸溶液时,溶液中所有的离子浓度均减小 |