题目内容
已知断开1molN≡N键需要akJ的能量,断开1molH-H需要bkJ的能量,形成1molN-H键放出ckJ的能量.工业上合成氨的反应是:N2(g)+3H2(g)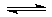 2NH3(g)△H<0,则该反应的△H为( )
2NH3(g)△H<0,则该反应的△H为( )
 2NH3(g)△H<0,则该反应的△H为( )
2NH3(g)△H<0,则该反应的△H为( )分析:化学反应中,化学键断裂吸收能量,形成新化学键放出能量,反应热的数值=|吸收的总能量-放出的总能量|.
解答:解:解:反应热=吸收的总能量-放出的总能量,所以1mol N2和3mol氢气反应需要吸收的能量为:(a+3b)KJ,生成2mol的氨气需要释放的能量为:6c,该反应是放热反应,所以放出的能量多于吸收的能量,所以△H=-(放收的总能量-吸收的总能量)=-(6c-3b-a)kJ?mol-1.
故选A.
故选A.
点评:本题考查反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.

练习册系列答案
相关题目
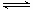 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol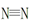 键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为
kJ。
键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为
kJ。