题目内容
有一在空气中暴露过的KOH固体,经分析知其内含:H2O 7.62%,K2CO3 2.38%,KOH 90%。若将1 g此样品加入到含HCl 1.683 g的盐酸里,过量的酸再用足量的氢氧化钾中和,蒸发中和后的溶液可得固体质量为( )
| A.3.43 g | B.4.00 g | C.4.50 g | D.无法计算 |
A
此题数据较多,组成复杂,若从分析混合物组成着手,很容易陷入陷阱,若从分析最终固体成分入手,则很容易找出计算方法。因为最终固体为KCl,K元素来源虽复杂,而Cl元素只来自1.683 g的盐酸中,故KCl的质量为: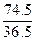 ×1.683 g="3.43" g。
×1.683 g="3.43" g。
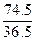 ×1.683 g="3.43" g。
×1.683 g="3.43" g。
练习册系列答案
相关题目