题目内容
(2012?邯郸一模)下列离子方程式书写不正确的是( )
分析:A.1:1反应生成亚硫酸氢钠,2:1反应生成亚硫酸钠,则当n(NaOH):n(SO2)=4:3时,生成物既有亚硫酸钠又有亚硫酸氢钠;
B.酸性溶液中不会生成OH-;
C.反应生成银氨络离子;
D.等体积互相均匀混合,物质的量之比为1:2.5,1:1反应生成氢氧化铝沉淀,1:4反应完成生成铝离子,则该反应生成Al(OH)3和Al3+.
B.酸性溶液中不会生成OH-;
C.反应生成银氨络离子;
D.等体积互相均匀混合,物质的量之比为1:2.5,1:1反应生成氢氧化铝沉淀,1:4反应完成生成铝离子,则该反应生成Al(OH)3和Al3+.
解答:解:A.NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时的离子反应为4OH-+3SO2=SO32-+2HSO3-+H2O,故A正确;
B.酸性条件下KIO3溶液与KI溶液发生反应生成I2的离子反应为IO3-+5I-+6H+=3I2+3H2O,故B错误;
C.AgNO3溶液中加入过量的氨水的离子反应为Ag++2NH3?H2O=[Ag(NH3)2]++2H2O,故C正确;
D.体积互相均匀混合,物质的量之比为1:2.5,1:1反应生成氢氧化铝沉淀,1:4反应完成生成铝离子,则该反应生成Al(OH)3和Al3+,离子反应为2AlO2-+5H+=Al(OH)3↓+Al3++H2O,故D正确;
故选B.
B.酸性条件下KIO3溶液与KI溶液发生反应生成I2的离子反应为IO3-+5I-+6H+=3I2+3H2O,故B错误;
C.AgNO3溶液中加入过量的氨水的离子反应为Ag++2NH3?H2O=[Ag(NH3)2]++2H2O,故C正确;
D.体积互相均匀混合,物质的量之比为1:2.5,1:1反应生成氢氧化铝沉淀,1:4反应完成生成铝离子,则该反应生成Al(OH)3和Al3+,离子反应为2AlO2-+5H+=Al(OH)3↓+Al3++H2O,故D正确;
故选B.
点评:本题考查离子反应方程式书写的正误判断,明确发生的反应是解答本题的关键,注意与量有关的离子反应为解答的难点,选项AD为解答的易错点和难点,题目难度中等.

练习册系列答案
相关题目
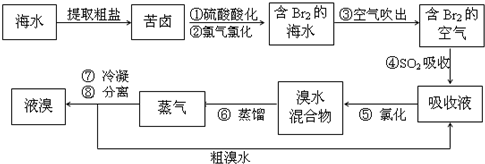

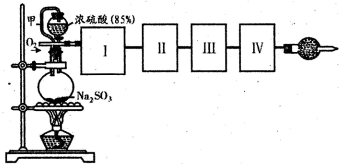
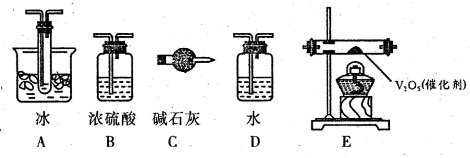
 (2012?邯郸一模)氢能被视作连接化石能源和可再生能源的重要桥梁.
(2012?邯郸一模)氢能被视作连接化石能源和可再生能源的重要桥梁.
