题目内容
甲、乙两烧杯中各盛有100mL3mol/L的硫酸和氢氧化钠溶液,向两烧杯中分别加入A克的铝粉,反应结束后测得生成的气体体积为甲:乙=3:4,下列说法正确的是
A.参加反应的H2SO4为0.2mol B.参加反应的NaOH约为0.27mol
C.加入铝粉的质量A=5.4 D.与硫酸反应的铝粉的质量7.2g
B
【解析】
试题分析:如果铝完全反应则生成的氢气体积是相等的,但由于反应结束后生成的氢气体积为甲:乙=3:4,这说明铝与稀硫酸反应时硫酸不足,铝过量。与氢氧化钠溶液反应时铝完全反应,氢氧化钠过量或恰好反应。A、硫酸的物质的量=0.1L×3mol/L=0.3mol,即参加反应的硫酸是0.3mol,A不正确;B、硫酸生成的氢气是0.3mol,所以氢氧化钠与铝反应生成的氢气是0.4mol,则根据方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,参加反应的氢氧化钠是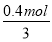 ×2=0.27mol,B正确;C、根据方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,参加反应的铝的物质的量=
×2=0.27mol,B正确;C、根据方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,参加反应的铝的物质的量= ×2,质量=
×2,质量=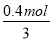 ×2×27g/mol=7.2g,C不正确;D、根据反应2Al+3H2SO4=Al2(SO4)3+3H2↑可知,参加反应的铝的质量=0.2mol×27g/mol=5.4g,D不正确,答案选B。
×2×27g/mol=7.2g,C不正确;D、根据反应2Al+3H2SO4=Al2(SO4)3+3H2↑可知,参加反应的铝的质量=0.2mol×27g/mol=5.4g,D不正确,答案选B。
考点:考查金属铝与稀硫酸、氢氧化钠溶液反应的有关判断和计算

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目