题目内容
【题目】短周期元素 A、B、C、D、E的原子序数依次增大,其中A元素的原子核外电子数、核外电子层数和最外层电子数均相等。B、C、D、E在元素周期表中的相对位置如左图所示,其中E的单质的水溶液具有漂白性。甲、乙、M、W、X、Y、Z七种物质均由 A、C、D三种元素中的若干种元素组成(只有M分子同时含有三种元素);甲、乙为非金属单质,是空气的主要组成成分;M、W、X、Y、Z均为化合物,W是C2A4型共价化合物,X分子中含有10个电子,它们之间的相互转化关系如右图所示;反应③的现象为气体变为红棕色。

(1)写出元素E在元素周期表中的位置________;
(2)A、C、D三种元素按4:2:3的比例组成而成的盐中,化学键类型为_________________。
(3)反应④的化学方程式为_________________。
(4)工业上采用氨的催化氧化方法制取化合物Y,请写出此化学方程式__________________。
(5)W作火箭燃料时,氧化剂可以是Z,0.25mol的W气体完全和足量的Z气体反应生成乙和X,转移的电子数为______mol。
【答案】 第三周期,第ⅦA 族 极性(共价)键、离子键 3NO + H2O== 2HNO3 + NO 4NH3+5O2![]() 4NO+6H2O 1 mol
4NO+6H2O 1 mol
【解析】短周期元素 A、B、C、D、E的原子序数依次增大,其中A元素的原子核外电子数、核外电子层数和最外层电子数均相等,A为H元素;B、C、D、E在元素周期表中的相对位置如左图所示,其中E的单质的水溶液具有漂白性,;B为C元素、C为N元素、D为O元素、E为Cl元素;甲、乙为非金属单质,是空气的主要组成成分,为O2和N2;W是C2A4型共价化合物,X分子中含有10个电子,它们之间的相互转化关系如右图所示;反应③的现象为气体变为红棕色。w是N2H4,与O2反应生成N2和H2O,Y为NO,Z为NO2,M为HNO3。
(1)元素E是Cl,在元素周期表中的位置第三周期,第ⅦA 族;(2)A、C、D三种元素按4:2:3的比例组成而成的盐NH4NO3中,化学键类型为NH4+ 与NO3―之间形成离子键,N―H、N―O之间形成极性(共价)键;(3)反应④的化学方程式为3NO + H2O== 2HNO3 + NO ;(4)氨的催化氧化的方程式: 4NH3+5O2![]() 4NO+6H2O;(5)N2H4+O2=N2+2H2O,1molN2H4反应转移4mol电子,则0.25mol的W气体完全和足量的Z气体反应生成乙和X,转移的电子数为1mol。
4NO+6H2O;(5)N2H4+O2=N2+2H2O,1molN2H4反应转移4mol电子,则0.25mol的W气体完全和足量的Z气体反应生成乙和X,转移的电子数为1mol。

【题目】某课外活动小组的同学进行探究银氨溶液温度对丙醛的银镜反应生成速率的影响。实验操作步骤简述如下:
1.准备好实验药品;2.准备好实验仪器;3.配制银氨溶液;
4.进行银氨溶液温度对丙醛的银镜反应生成速率的影响探究实验。
请回答下列问题:
(1)丙醛发生银镜反应的化学方程式为: 。
(2)银镜反应选择的加热方法是 (填下列装置编号)。
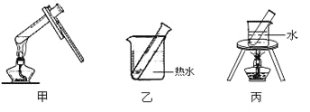
(3)该兴趣小组的同学探究银氨溶液的温度对丙醛的银镜反应生成速率的影响。参照下表格,
在实验前拟定好实验记录表格,完整体现实验方案(只列出需记录物理量和单位,不用填写实验数据):
实验变量 实验序号 | 银氨溶液的量/mL | |||
1 | ||||
2 |
(4)实验完清洗试管内壁附着的银镜方法是:
(5)你认为探究丙醛进行银镜反应的最佳条件,除了测定银镜出现的时间外,还需要比较不同条件下形成的银镜的 。


