题目内容
(2008?梅州一模)已知298K时,N2(g)+3H2(g)=2NH3(g);△H=-92.4kJ/mol,在相同条件下,向密闭容器中加入1molN2和3molH2,达到平衡时放出的热量为Q1,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2和0.1molNH3,达到平衡时放出的热量为Q2,则下列关系式正确的是( )
分析:因该反应为可逆反应,不能完全转化,而热化学反应中的反应热为物质完全转化时的能量变化,则Q1<92.4kJ,
从等效平衡的角度分析,0.95molN2、2.85molH2和0.1molNH3相当于1molN2和3molH2,达到同一平衡状态,因为含有0.1molNH3,则放出的热量Q2<Q1.
从等效平衡的角度分析,0.95molN2、2.85molH2和0.1molNH3相当于1molN2和3molH2,达到同一平衡状态,因为含有0.1molNH3,则放出的热量Q2<Q1.
解答:解:题给热化学方程式中的△H=-92.4kJ/mol是指1molN2(g)和3molH2(g)和完全反应的反应热,而将1molN2(g)和3molH2(g)在一定条件下反应时,是一个可逆反应,不可能全部反应,故反应放出的热量应小于92.4KJ.
另一容器中的反应建立的平衡与前一容器建立的平衡应为等效平衡,平衡时各物质的量相等,但由于第二种情况下,容器中已有0.1molNH3,反应再生成的NH3比另一容器中的反应建立的平衡时生成量少,故Q2<Q1,
故选C.
另一容器中的反应建立的平衡与前一容器建立的平衡应为等效平衡,平衡时各物质的量相等,但由于第二种情况下,容器中已有0.1molNH3,反应再生成的NH3比另一容器中的反应建立的平衡时生成量少,故Q2<Q1,
故选C.
点评:本题不仅考查了反应热的概念,还同时考查了可逆反应,等效平衡等概念,综合性较强,考生只有在准确理解上述概念的基础上,才能准确作答.由于“化学反应中的能量变化”,新教材已将其作为另一条主线贯穿于教材始终,故能量变化问题几乎可与任何一章相联系、相综合,复习中应多加留意.

练习册系列答案
相关题目
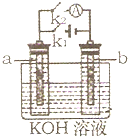 (2008?梅州一模)如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )
(2008?梅州一模)如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )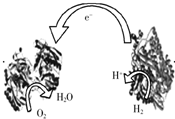 (2008?梅州一模)2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池.该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中.由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示.下列说法正确的是( )
(2008?梅州一模)2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池.该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中.由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示.下列说法正确的是( )