题目内容
下列叙述中正确的是( )
分析:A.氯化钠溶于水就发生电离,与有无电流无关;
B.电离产生的阳离子全为H+的化合物是酸;
C.碳酸钙在熔融下完全电离;
D.氨气本身没有发生电离.
B.电离产生的阳离子全为H+的化合物是酸;
C.碳酸钙在熔融下完全电离;
D.氨气本身没有发生电离.
解答:解:A.因氯化钠溶于水电离成Na+和Cl-,在电流作用下离子作定向移动,故A错误;
B.电离产生的阳离子全为H+的化合物是酸,如硫酸氢钠为盐,故B错误;
C.碳酸钙在熔融下完全电离,则CaCO3的水溶液导电性很弱,但CaCO3属于电解质,故C正确;
D.NH3溶于水所得溶液能导电,是一水合氨电离产生离子,氨气本身没有发生电离,则氨气属于非电解质,故D错误;
故选C.
B.电离产生的阳离子全为H+的化合物是酸,如硫酸氢钠为盐,故B错误;
C.碳酸钙在熔融下完全电离,则CaCO3的水溶液导电性很弱,但CaCO3属于电解质,故C正确;
D.NH3溶于水所得溶液能导电,是一水合氨电离产生离子,氨气本身没有发生电离,则氨气属于非电解质,故D错误;
故选C.
点评:本题考查电解质在水中的电离,明确电离的条件及物质的溶解性、电解质的概念等即可解答,难度不大.

练习册系列答案
相关题目
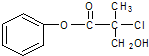 有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )
有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )| A、有机物A可以在一定条件下与HBr发生反应 | B、1mol A最多能与4mol H2发生加成反应 | C、有机物A与浓硫酸混合加热,可以发生消去反应 | D、1mol A与足量的NaOH溶液反应,最多可以消耗3mol NaOH |


