题目内容
有下列几种晶体,完成下列各小题.A.干冰 B.氯化钠 C.冰 D.水晶 E.氯化铵 F.晶体氖 G.铝 H.C60 I.金刚石
(1)属于分子晶体的是
(2)晶体中有氢键的是
分析:(1)分子晶体的构成微粒为分子,分子间以分子间作用力相互结合;原子晶体的构成微粒为原子,原子间以共价键相互结合;
(2)氢原子与电负性大、半径小的原子X(氟、氧、氮等)以共价键结合,若与电负性大的原子Y(与X相同的也可以)接近,在X与Y之间以氢为媒介,生成X-H…Y形式的键,称为氢键;原子晶体受热熔化需要克服共价键.
(2)氢原子与电负性大、半径小的原子X(氟、氧、氮等)以共价键结合,若与电负性大的原子Y(与X相同的也可以)接近,在X与Y之间以氢为媒介,生成X-H…Y形式的键,称为氢键;原子晶体受热熔化需要克服共价键.
解答:解:(1)干冰、冰、晶体氖、C60都是由分子构成的分子晶体;水晶(二氧化硅)、金刚石是由原子构成的原子子晶体;氯化钠、氯化铵都是由离子构成的离子晶体;铝属于金属晶体,
故答案为:ACFH;BE;
(2)冰的化学成分是水,水分子之间可构成氢键;水晶(二氧化硅)、金刚石是由原子构成的原子晶体,原子晶体熔化需克服共价键,
故答案为:C;DI.
故答案为:ACFH;BE;
(2)冰的化学成分是水,水分子之间可构成氢键;水晶(二氧化硅)、金刚石是由原子构成的原子晶体,原子晶体熔化需克服共价键,
故答案为:C;DI.
点评:本题考查晶体类型的判断、晶体中粒子间作用力、氢键等知识点,题目难度不大,注意知识的积累.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验.
实验Ⅰ反应产物的定性探究
按如图装置(固定装置已略去)进行实验
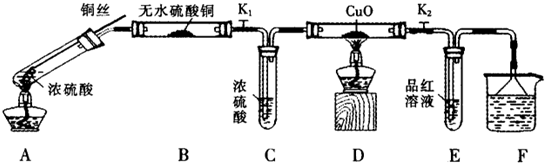
(1)F烧杯中的溶液是 .
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 .
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是 .
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 .
(5)为说明浓硫酸中的水会否影响B装置现象的判断,还须进行一次实验.实验方案为 .
实验Ⅱ反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
资料1:
资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种.
仅由上述资料可得出的正确结论是 .
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15mol?L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol?L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL.若反应消耗铜的质量为ag,则硫酸铜的产率为 .
(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
实验Ⅰ反应产物的定性探究
按如图装置(固定装置已略去)进行实验

(1)F烧杯中的溶液是
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是
(5)为说明浓硫酸中的水会否影响B装置现象的判断,还须进行一次实验.实验方案为
实验Ⅱ反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
资料1:
| 硫酸/mol?L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
仅由上述资料可得出的正确结论是
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15mol?L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol?L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL.若反应消耗铜的质量为ag,则硫酸铜的产率为
(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
现有几种物质的熔点数据如下表:
| A组 | B组 | C组 | D组 |
| 金刚石:3 550℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1 410℃ | Na:98℃ | HCl:-115℃ | KCl:776℃ |
| 硼晶体:2 300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅1 723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
据此完成下列问题:
(1)A组属于_______________晶体,其熔化时克服的粒子间的作用力是_______________。
(2)B组晶体共同的物理性质是_______________ (填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于______________________________。
(4)D组晶体可能具有的性质是_______________ (填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
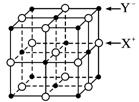
(5)XY晶体的单元结构如下图所示,晶体中距离最近的X+与Y-的核间距离为a cm,已知阿伏加德罗常数为Na mol-1,其密度为ρ g·cm-3,则XY的摩尔质量可表示为________ g·mol-1。