题目内容
(8分)已知:①MnO4— +e- MnO42―(绿色)(强碱性条件)
MnO42―(绿色)(强碱性条件)
②MnO4—+ 8H+ + 5e- Mn2+(无色)+ 4H2O(强酸性条件)
Mn2+(无色)+ 4H2O(强酸性条件)
(1)在KOH溶液中,KMnO4与K2SO3溶液发生反应, 写出反应的离子方程式 。
(2)将KMnO4溶液滴入NaOH溶液微热,得到透明的绿色溶液,写出反应的离子方程式 .
(3)用酸性KMnO4溶液与亚铁盐的反应证明Fe2+具有还原性,MnO4?具有氧化性,最合适的亚铁盐是 (选填编号),可用来酸化KMnO4溶液的试剂是 (选填编号)
a. FeCl2 b. FeSO4 c.Fe(NO3)2 d稀硫酸 e. 盐酸 f. 硝酸
(4)向20 mL浓度为0.05mol/L的KMnO4溶液中滴加FeSO4溶液,使MnO4?全部转化为Mn2+ ,则反应前需向KMnO4溶液加入c(H+)=1mol/L的酸不少于 mL
 MnO42―(绿色)(强碱性条件)
MnO42―(绿色)(强碱性条件)②MnO4—+ 8H+ + 5e-
 Mn2+(无色)+ 4H2O(强酸性条件)
Mn2+(无色)+ 4H2O(强酸性条件)(1)在KOH溶液中,KMnO4与K2SO3溶液发生反应, 写出反应的离子方程式 。
(2)将KMnO4溶液滴入NaOH溶液微热,得到透明的绿色溶液,写出反应的离子方程式 .
(3)用酸性KMnO4溶液与亚铁盐的反应证明Fe2+具有还原性,MnO4?具有氧化性,最合适的亚铁盐是 (选填编号),可用来酸化KMnO4溶液的试剂是 (选填编号)
a. FeCl2 b. FeSO4 c.Fe(NO3)2 d稀硫酸 e. 盐酸 f. 硝酸
(4)向20 mL浓度为0.05mol/L的KMnO4溶液中滴加FeSO4溶液,使MnO4?全部转化为Mn2+ ,则反应前需向KMnO4溶液加入c(H+)=1mol/L的酸不少于 mL
(共8分)(1) 2MnO4—+SO32―+ 2OH—="==" 2MnO42―+SO42―+ H2O(2分)
(2) 4MnO4—+4OH—="==" MnO42―+2H2O +O2↑(2分)
(3) b d(各1分,共2分)(4)8ml(2分)
(2) 4MnO4—+4OH—="==" MnO42―+2H2O +O2↑(2分)
(3) b d(各1分,共2分)(4)8ml(2分)
由题目所给条件可知MnO4—在酸性、碱性条件下氧化能力不同:在强碱性条件下生成MnO42―、在酸性条件下生成Mn2+。
(1)(2)一般是根据化合价的升降守恒、电荷守恒、原子守恒进行离子方程式的配平
(3)由于氯离子可还原MnO4—、NO3—在酸性条件下氧化性很强,故最合适的亚铁盐是FeSO4,酸化KMnO4溶液的试剂最好是硫酸
(4)由方程式MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O可得所需c(H+)=1mol/L的硫酸体积为:
V=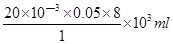 ="8" ml
="8" ml
(1)(2)一般是根据化合价的升降守恒、电荷守恒、原子守恒进行离子方程式的配平
(3)由于氯离子可还原MnO4—、NO3—在酸性条件下氧化性很强,故最合适的亚铁盐是FeSO4,酸化KMnO4溶液的试剂最好是硫酸
(4)由方程式MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O可得所需c(H+)=1mol/L的硫酸体积为:
V=
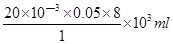 ="8" ml
="8" ml
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 Se+I2+KNO3+H2O
Se+I2+KNO3+H2O
 CO2+H2?
CO2+H2? 2HNO3+NO?
2HNO3+NO?