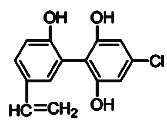
题目内容
【题目】【物质结构与性质】(13分)
Fe、C、N、O、H可以组成多种物质。回答以下问题:
(1)基态铁原子中,未成对电子数有 个。
(2)铁单质在一定条件下可与CO反应生成配位化合物——羰基铁[Fe(CO)5],其结构如图。已知CO分子与N2分子结构相似,分子中C、O原子均能提供孤电子对形成配位键。

①CO分子中σ键与π键数目之比为 ;
②从电负性角度分析,Fe(CO)5中与Fe形成配位键的是 (填“碳”或“氧”)原子。
③与羰基铁分子的极性相似的分子是 。
A.SO2 B.CS2 C.BF3 D.PCl3
(3)CH4、H2O分子的键角分别为a、b。则a b(填>、=或<),原因是 。
(4)血红素分子结构如图所示。

①血红素分子间存在的作用力有 (填名称);
②与Fe通过配位键结合的氮原子的编号是 。
【答案】(13分)
(1)4 (2)①1:2 ② C ③ B、C
(3)> 水分子中氧原子存在孤对电子和成键电子对,甲烷分子中存在孤对电子,孤对电子产生排斥作用强于成对电子
(4)①范德华力和氢键 ②1和3
【解析】
试题分析:(1)铁是26号元素,电子排布式为1s22s22p63s23p63d64s2,根据泡利不相容原理和洪特规则知d能级上有未成对电子,由于d能级有5个轨道,所以d能级有4个未成对电子。
(2)①根据等电子体理论,CO和N2互为等电子体,氮气中存在氮氮叁键,所以CO分子中σ键与π键数目之比为1:2;
②C、O属于同周期元素,从左到右,电负性逐渐增大,则电负性C<O,所以Fe(CO)5中与Fe形成配位键的是碳原子
③根据图示,羰基铁分子构型为三角双锥,呈中心对称结构,非极性分子,A.SO2是V形分子,极性分子,B.CS2是直线形分子,非极性子,C.BF3 是平面正三角形,非极性分子,D.PCl3是三角锥分子,是极性分子,选B、C。
(3)水分子中氧原子存在孤对电子和成键电子对,甲烷分子中只存在孤对电子,孤对电子产生排斥作用强于成对电子,所以CH4、H2O分子的键角分别为a、b。则a>b。
(4)根据血红素分子结构所示①血红素分子间存在的作用力有范德华力和氢键;②与Fe通过配位键结合的氮原子的编号是1和3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】中学化学中下列各物质间不能实现![]() (“→”表示一步完成)转化的是:
(“→”表示一步完成)转化的是:
A | B | C | D | |
a | CH3CH2OH | CH2===CH2 | 硬脂酸 | HCOOCH3 |
b | CH3CHO | CH3CH2Br | 硬脂酸甘油酯 | CH3OH |
c | CH3COOH | CH3CH2OH | 硬脂酸钠 | HCOOH |
A. A B. B C. C D. D
【题目】氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂。某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用下图所示的装置制备NCl3,并探究NCl3的漂白性。
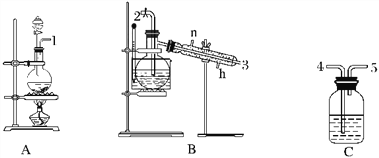
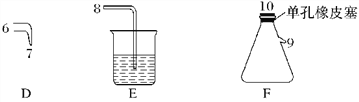
NCl3的相关性质如下:
物理性质 | 制备原理 | 化学性质 |
黄色油状液体,熔点为-40 ℃,沸点为71 ℃,不溶于冷水,易溶于有机溶剂,密度为1.65 g·mL-1 | Cl2与NH4Cl水溶液在低温下反应 | 95 ℃爆炸,热水中能与水反应 |
回答下列问题:
(1)根据实验目的,接口连接的顺序为1→____________________________________。
(2)C装置作用是_________________________________________________________________。
(3)B装置中发生反应的化学方程式为____________________________________,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为________________。
(4)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50~60 ℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,写出有关化学反应方程式并解释实验现象:___________________________________________。