题目内容
某课外活动小组使用下列用品设计原电池.用品:铜片、铁片、导线、金属夹、发光二极管、果汁(橙汁、苹果汁)500 mL、烧杯.下列说法正确的是
- A.该装置能将电能转化为化学能
- B.实验过程中铜片逐渐溶解
- C.电子由铁片通过导线流向铜片
- D.铁片上会析出红色的铜
C
原电池是将化学能转变为电能;该原电池铁片作负极,铜片作正极,铁片逐渐溶解;电子由负极(铁片)通过导线流向正极(铜片);果汁中所含酸中的H+在铜片上得电子被还原成H2.
原电池是将化学能转变为电能;该原电池铁片作负极,铜片作正极,铁片逐渐溶解;电子由负极(铁片)通过导线流向正极(铜片);果汁中所含酸中的H+在铜片上得电子被还原成H2.

练习册系列答案
相关题目
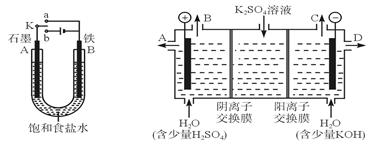
 4SiHCl3(g)
4SiHCl3(g)
 4SiHCl3(g)
4SiHCl3(g)
 4SiHCl3(g),达到平衡后,H2与SiHCl3的物质的量浓度分别为0.140mol/L和0.020 mol/L,若H2全部来源于图Ⅱ离子交换膜法的电解产物,理论上需消耗硫酸钾质量为______kg。
4SiHCl3(g),达到平衡后,H2与SiHCl3的物质的量浓度分别为0.140mol/L和0.020 mol/L,若H2全部来源于图Ⅱ离子交换膜法的电解产物,理论上需消耗硫酸钾质量为______kg。 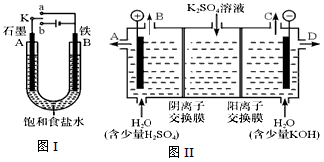
 4SiHCl3(g)达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于图Ⅱ离子交换膜法的电解产物,理论上需消耗硫酸钾质量为________kg。
4SiHCl3(g)达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于图Ⅱ离子交换膜法的电解产物,理论上需消耗硫酸钾质量为________kg。