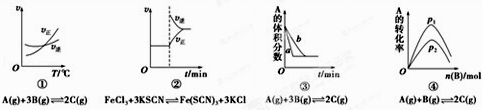
题目内容
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2的离子化合物.
(1)写出Y2O2的电子式: , 其中含有的化学键是 .
(2)用电子式表示Y2O的形成过程 .
(3)X、Z、W三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是(填化学式).
(4)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是(填化学式).
(5)由X、W组成的化合物分子中.X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式 .
【答案】
(1)![]() ;离子键、共价键
;离子键、共价键
(2)![]()
(3)HNO3
(4)NH3
(5)NCl3+3H2O=NH4ClO+2HClO
【解析】解:原子序数由小到大排列的四种短周期元素X、Y、Z、W,Y与氧元素可组成Y2O和Y2O2的离子化合物,Y为Na,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物,可知X为N,Z为S,W为Cl,(1)Y2O2为Na2O2 , 电子式为 ![]() ,含离子键、共价键, 所以答案是:
,含离子键、共价键, 所以答案是: ![]() ;离子键、共价键;(2)Na2O为离子化合物,用电子式表示形成过程为
;离子键、共价键;(2)Na2O为离子化合物,用电子式表示形成过程为 ![]() ,
,
所以答案是: ![]() ;(3)X、Z、W三种元素的最高价氧化物对应的水化物,分别为硝酸、硫酸、高氯酸,稀溶液中只有HNO3具有强氧化性,
;(3)X、Z、W三种元素的最高价氧化物对应的水化物,分别为硝酸、硫酸、高氯酸,稀溶液中只有HNO3具有强氧化性,
所以答案是:HNO3;(4)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是NH3 , 所以答案是:NH3;(5)X、W原子的最外层均达到8电子稳定结构,该化合物为NCl3 , 遇水可生成一种具有漂白性的化合物为HClO,该反应为NCl3+3H2O=NH4ClO+2HClO,
所以答案是:NCl3+3H2O=NH4ClO+2HClO.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案