题目内容
下列有关钢铁腐蚀与防护的说法正确的是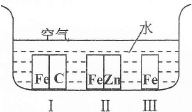
| A.钢管与铜管露天堆放在一起,钢管不易被腐蚀 |
| B.在右图所示环境中,铁被腐蚀速率:I>Ⅲ>Ⅱ |
| C.铁制品保存在温度较高的地方 |
| D.钢铁发生电化学腐蚀时,负极反应是Fe—3eˉ=Fe3+ |
B
解析试题分析:A、Fe、Cu露天堆放时,Fe易发生电化学腐蚀,错误;B、I中Fe发生吸氧腐蚀,III中Fe发生化学腐蚀,II中Fe受到保护,正确;C、温度较高,铁腐蚀速率加快,错误;D、Fe与溶液中的Fe3+易反应生成Fe2+,则负极反应式为Fe—2eˉ=Fe2+,错误。
考点:考查钢铁腐蚀等相关知识。

练习册系列答案
相关题目
下列物质的有关事实与电化学腐蚀无关的是
| A.轮船水线以下的船壳上镶嵌有一定量的锌块 |
| B.镀锌的铁制品比镀锡的铁制品耐用 |
| C.埋在潮湿疏松土壤里的铁管比干燥致密不透气的土壤里的铁管更易被腐蚀 |
| D.在空气中,金属镁、铝的表面可形成一层氧化膜 |
某污水中含有Fe3+、Ag+、Cu2+等离子,某工厂采用电解的方法处理该污水,具体的做法是:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用,阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。该厂污水处理设计装置如图所示,下列说法正确的是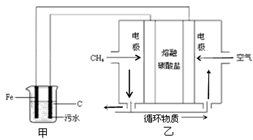
| A.为了增加污水的导电能力,可向污水中如入适量的Na2SO4固体 |
| B.甲装置中Fe电极的反应为Fe-3e-=Fe3+ |
| C.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环物质为H2O |
| D.当乙装置中有1.6gCH4参加反应,则C电极理论上生成气体在标准状况下为8.96L |
下列说法正确的是
| A.电解稀硫酸溶液,溶液的浓度会逐渐变大,pH逐渐变大 |
| B.氯碱工业中,电路中每转移1mol电子,理论上收集到1mol气体 |
| C.向电解氯化钠溶液所得的稀溶液中,加入浓盐酸,能恢复到原溶液浓度 |
| D.粗铜精炼时,粗铜应作电解池的阳极,电解质溶液在电解过程中浓度不变 |
如图为铁片上镀铜的实验装置,下列说法正确的是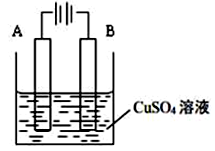
| A.Cu2+在A极被还原 |
| B.硫酸铜溶液浓度变小 |
| C.铜片连接电源正极,铁片上发生还原反应 |
| D.B极发生反应:Cu-2e-=Cu2+ |
寒冷的冬天,经常使用暖宝宝,暖宝宝中装的是铁粉、活性炭、无机盐等物质,打开包装以后,可以连续12个小时释放热量,以下分析错误的是
| A.将化学能转化为热能 |
| B.其发热原理与钢铁的吸氧腐蚀相同 |
| C.铁作负极,电极反应为:Fe – 3e → Fe3+ |
| D.活性炭作正极,电极反应为:2H2O + O2 + 4e → 4OH- |
家用炒菜锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不会发生的化学反应是
| A.4Fe(OH)2+2H2O+O2=4Fe(OH)3 | B.2Fe+2H2O+O2=2Fe(OH)2 |
| C.2H2O+O2+4e-=4OH- | D.Fe-3e-=Fe3+ |
一定条件下,碳钢腐蚀与溶液pH的关系如下:
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | |||
A.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
B.在pH>6溶液中,碳钢主要发生吸氧腐蚀
C.在pH>7溶液中,碳钢腐蚀的正极反应为O2+4H++4e→2H2O
D.在pH<4溶液中,碳钢主要发生析氢腐蚀
用惰性电极电解某金属元素R的硝酸盐R(NO3)n溶液,通电一段时间后,阳极产生气体V L(标准状况)时,阴极质量增加m g,若R的相对原子质量为M,设NA为阿伏加德罗常数的值,下列叙述中不正确的是
A.电路中通过电子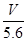 NA NA | B.n = 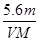 |
C.溶液中H+增加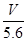 NA NA | D.n = 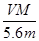 |