题目内容
有CO与CO2的混合气体共33.6 L,其密度为1.726 g/L,已知混合气体共有9.03×1023个分子,则该混合气体的平均摩尔质量是多少?CO与CO2的分子个数比是多少?
38.67 g/mol;1:2
m(总)=1.726g/L×33.6L=58g
n(总)=N÷NA=9.03×1023÷6.02×1023mol-1=1.5mol
M(平均)=m(总)÷n(总)="58" g÷1.5mol=38.67g/mol
又因为m(总)=[28n(CO)+44n(CO2)]g 、n(总)=" [n(CO)+" n(CO2)]mol
所以有:M(平均)=m(总)÷n(总)="[" 28n(CO)+44n(CO2)]÷[n(CO)+ n(CO2)]mol=38.67g/mol解得:n(CO): n(CO2)= 1:2
n(总)=N÷NA=9.03×1023÷6.02×1023mol-1=1.5mol
M(平均)=m(总)÷n(总)="58" g÷1.5mol=38.67g/mol
又因为m(总)=[28n(CO)+44n(CO2)]g 、n(总)=" [n(CO)+" n(CO2)]mol
所以有:M(平均)=m(总)÷n(总)="[" 28n(CO)+44n(CO2)]÷[n(CO)+ n(CO2)]mol=38.67g/mol解得:n(CO): n(CO2)= 1:2

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
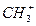 中含有的电子数为NA
中含有的电子数为NA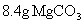 和
和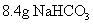
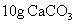 和
和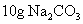
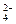 为
为