题目内容
下列说法正确的是( )
| A、原子最外层电子数为2的元素一定处于周期表ⅡA族或零族 |
| B、CO和N2是等电子体,CO2和N2O也是等电子体 |
| C、离子化合物中不可能存在共价键 |
| D、离子化合物和共价化合物在熔融时都导电,水溶液中也都导电 |
考点:元素周期表的结构及其应用,离子化合物的结构特征与性质,“等电子原理”的应用
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A.原子最外层电子数为2的元素,可能为Ti、V;
B.等电子体中原子数相同,价电子数相同;
C.离子化合物可能含共价键;
D.共价化合物在熔融时不能导电.
B.等电子体中原子数相同,价电子数相同;
C.离子化合物可能含共价键;
D.共价化合物在熔融时不能导电.
解答:
解:A.原子最外层电子数为2的元素,可能为Ti、V(副族元素),也可能为ⅡA族或零族的He,故A错误;
B.CO和N2,CO2和N2O中原子数相同,价电子数相同,则为等电子体,故B正确;
C.离子化合物可能含共价键,如NaOH中含O-H共价键,故C错误;
D.共价化合物在熔融时不能导电,不存在离子,而离子化合物在熔融时都导电,水溶液中也都导电,故D错误;
故选B.
B.CO和N2,CO2和N2O中原子数相同,价电子数相同,则为等电子体,故B正确;
C.离子化合物可能含共价键,如NaOH中含O-H共价键,故C错误;
D.共价化合物在熔融时不能导电,不存在离子,而离子化合物在熔融时都导电,水溶液中也都导电,故D错误;
故选B.
点评:本题考查较综合,涉及元素周期表的结构与应用、等电子体、化学键及物质分类等,为高频考点,注重基础知识的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
常温下,某无色透明溶液中由水电离产生的c(OH-)=1×10-11mol?L-1,在该溶液中一定能大量共存的离子组是( )
| A、MnO4-、NO3-、Na+、K+ |
| B、Cl-、SO42-、Na+、Ba2+ |
| C、AlO2-、OH-、Na+、Ba2+ |
| D、NO3-、SO42-、Na+、K+ |
工业制氢气的一个重要反应是:CO(g)+H2O(g)═CO2(g)+H2(g)
已知在25℃时:C(石墨,s)+
O2(g)═CO(g)△H=-111k J/mol
H2(g)+
O2(g)═H2O(g)△H=-242k J/mol
C(石墨,s)+O2(g)═CO2(g)△H=-394k J/mol
则25℃时1mol CO与水蒸气作用转化为氢气和二氧化碳反应△H为( )
已知在25℃时:C(石墨,s)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
C(石墨,s)+O2(g)═CO2(g)△H=-394k J/mol
则25℃时1mol CO与水蒸气作用转化为氢气和二氧化碳反应△H为( )
| A、32 kJ/mol |
| B、-41 kJ/mol |
| C、283 kJ/mol |
| D、-131 kJ/mol |
绿色化学对于化学反应提出了“原子经济性”的新概念及要求.理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放.下列几种生产乙苯的方法中,原子经济性最好的是( )
A、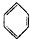 +C2H5Cl→ +C2H5Cl→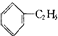 +HCl +HCl |
B、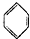 +C2H5OH→ +C2H5OH→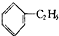 +H2O +H2O |
C、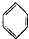 +CH2=CH2→ +CH2=CH2→ |
D、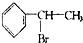 → → +HBr +HBr |
下列关于实验现象的描述,不正确的是( )
| A、乙醇与钠反应时,钠块沉到试管底部,缓慢放出气体 |
| B、用灯光照射盛有CH4与Cl2(体积比1:4)的集气瓶后,可观察到瓶内壁附有油状物质 |
| C、将红热的铜丝迅速插入乙醇中,可观察到铜丝表面变黑,反复多次,并能闻到香味 |
| D、酯化反应结束后,饱和碳酸钠溶液上面有一层无色油状物,可以闻到芳香 |
下列有关化学用语表示正确的是( )
A、四氯化碳分子比例模型: | ||
B、COS的电子式是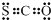 | ||
| C、次氯酸的结构式为 H-Cl-O | ||
D、
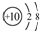 |
下列物质能使干燥的蓝色石蕊试纸变红又褪色的是( )
(1)氯气 (2)液氯 (3)新制氯水 (4)氯气的酒精溶液 (5)盐酸 (6)过量盐酸酸化过的漂泊粉溶液.
(1)氯气 (2)液氯 (3)新制氯水 (4)氯气的酒精溶液 (5)盐酸 (6)过量盐酸酸化过的漂泊粉溶液.
| A、(1)(2)(3) |
| B、(1)(2)(3)(6) |
| C、(3)(4)(6) |
| D、(3)(6) |
下列有关物质的量浓度关系正确的是( )
| A、物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,溶液呈酸性:c(CH3COO-)<c(CH3COOH) |
| B、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
| C、0.1mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
| D、pH=2的HA溶液与pH=12的MOH溶液任意比混合后溶液中离子浓度关系:c(H+)+c(M+)=c(OH-)+c(A-) |
有一瓶Na2SO3溶液,可能已部分氧化,某学生进行如下实验:取少量溶液,滴入Ba(NO3)2溶液产生白色沉淀,再加入过量稀硝酸溶液,充分振荡后仍有白色沉淀,结论正确的是( )
| A、Na2SO3溶液已部分氧化 |
| B、加入Ba(NO3)2溶液后生成的沉淀中一定含有BaSO4 |
| C、加硝酸后的不溶沉淀一定是BaSO4 |
| D、此实验能确定Na2SO3溶液是否部分氧化 |