题目内容
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B和G是液体,其余均为气体,1mol X分解得到A、B、C各1mol. 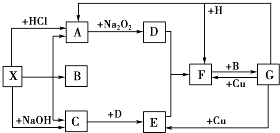
试回答下列各题:
(1)写出下列物质的化学式:X , B .
(2)写出下列反应的化学方程式: ①H+G﹣→A+F: .
②C+D﹣→E: .
(3)写出下列反应的离子方程式: G+Cu﹣→E: .
【答案】
(1)NH4HCO3;H2O
(2)C+4HNO3(浓) ![]() ?CO2↑+4NO2↑+2H2O;4NH3+5O2
?CO2↑+4NO2↑+2H2O;4NH3+5O2 ![]() ?4NO+6H2O
?4NO+6H2O
(3)3Cu+2NO3﹣+8H+═3Cu2++2NO↑+4H2O
【解析】解:常温下X和H是固体,B和G是液体,由框图可知X既能与酸反应生成气体A,又能与碱反应生成气体C,故X应为弱酸的铵盐,该弱酸易分解,而且产生的气体能与Na2O2反应,猜想X应为NH4HCO3或(NH4)2CO3 , 又知1 mol X分解得到A、B、C各1 mol,故X只能是NH4HCO3 , A为CO2 , B为H2O,C为NH3 , D为O2 , E为NO,F为NO2 , G为HNO3 , H为C,(1)由以上分析可知X为NH4HCO3 , B为H2O,故答案为:NH4HCO3;H2O;(2)①H+G→A+F为C和浓硝酸的反应,方程式为C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O, 故答案为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O, 故答案为:C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O;②C+D→E的反应为4NH3+5O2
CO2↑+4NO2↑+2H2O;②C+D→E的反应为4NH3+5O2 ![]() 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2 ![]() 4NO+6H2O;(3)铜和稀硝酸反应生成硝酸铜和一氧化氮,反应的离子方程式为3Cu+2NO3﹣+8H+=3Cu2++2NO↑+4H2O;
4NO+6H2O;(3)铜和稀硝酸反应生成硝酸铜和一氧化氮,反应的离子方程式为3Cu+2NO3﹣+8H+=3Cu2++2NO↑+4H2O;
故答案为:3Cu+2NO3﹣+8H+=3Cu2++2NO↑+4H2O;
常温下X和H是固体,B和G是液体,其余均为气体由框图可知X既能与酸反应生成气体A,又能与碱反应生成气体C,故X应为弱酸的铵盐,该弱酸易分解,而且产生的气体能与Na2O2反应,猜想X应为NH4HCO3或(NH4)2CO3 , 又知1 mol X分解得到A、B、C各1 mol,故X只能是NH4HCO3 , A为CO2 , B为H2O,C为NH3 , D为O2 , E为NO,F为NO2 , G为HNO3 , H为C,结合对应物质的性质以及题目要求可解答该题.




