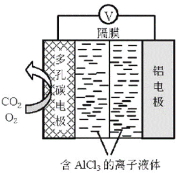
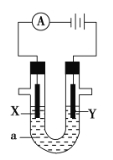
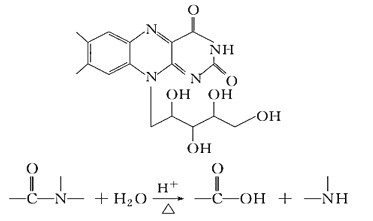
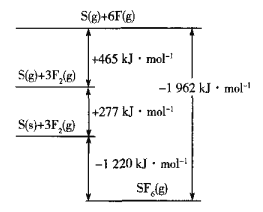
题目内容
【题目】化学使我们的生活更加美好。使用自热材料的暖贴、自热食品极大的方便了人们的生活。
(1)自热材料是利用化学反应原理,将_____能转化为热能供人们使用。一般利用原电池原理来_____(“加快”或“减慢”)放热速度。
(2)暖贴中自热材料的主要化学成分有:铁粉、炭粉、氯化钠固体、其他辅助成分及保温材料等,并用可控制氧气透过速率的无纺布包装。在工作时,铁粉与炭粉形成原电池反应,该反应过程中的能量变化关系图中,正确的是______。

(3)控制适当的氧气透过速率,使暖贴保持一个适合人体的温度,无纺布非常重要。制作无纺布的原料为丙烯,丙烯结构如图。关于丙烯分子内的相互作用有______。
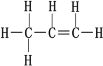
A.共价键 B.离子键 C.范德华力 D.氢键
(4)自热食品的自热材料中,除有暖贴当中的成分外,还有生石灰、铝粉、碳酸钠等,仍用无纺布包装。使用时先加适量的水。开始时有放热的非氧化还原反应发生,其化学方程式为_____。然后会形成强碱性溶液,并进一步发生剧烈反应,并产生一种易燃易爆的气体,大量放热,将食品煮熟。该反应的离子方程式为:_______。商家为保证迅速放热,采取了以下哪些加速反应的措施:_____。
①形成原电池反应 ②将铝粒制成铝粉 ③增大压强 ④使用催化剂
【答案】化学 加快 B A CaO+H2O=Ca(OH)2 2Al+2OH-+2H2O=2AlO2-+3H2↑ ①②
【解析】
(1)自热材料通过化学反应,将化学能转化为热能;构成原电池加快反应速率,所以一般利用原电池原理来加快反应速度;
(2)暖贴中铁粉、炭粉、氯化钠固体及其他辅助成分的反应是放热反应,反应物的总能量大于生成物的总能量,故选B;
(3)丙烯分子是共价分子,分之内只含C-H、C-C、C=C共价键,故选A;
(4)自热食品的自热材料中,生石灰和水反应生成氢氧化钙是放热的非氧化还原反应,反应方程式是CaO+H2O=Ca(OH)2;
铝和强碱反应放出氢气,反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑;
①自热材料中铝、碳构成原电池,能加快反应速率,故选①;②将铝粒制成铝粉,增大了接触面积,加快反应速率,故选②;③用无纺布包装,没有增大压强,故不选③;④根据加入材料分析,没有使用催化剂,故不选④;选①②。