题目内容
水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前________和________是主要的去离子方法。
(2)ClO2是一种性能优良的消毒剂,可将废水中少量的S2-、NO2-和CN-等有毒有害的还原性离子氧化除去。请写出ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式________。
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行________处理。把进行过离子交換的CaR2(或MgR2)型树脂置于______中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,右面是海水利用电渗析法获得淡水的原理图,已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请回答:
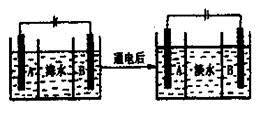
①阳离子交换膜是指________(填“A”或“B”)。
②写出通电后阳极区的电极反应式________________。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前________和________是主要的去离子方法。
(2)ClO2是一种性能优良的消毒剂,可将废水中少量的S2-、NO2-和CN-等有毒有害的还原性离子氧化除去。请写出ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式________。
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行________处理。把进行过离子交換的CaR2(或MgR2)型树脂置于______中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,右面是海水利用电渗析法获得淡水的原理图,已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请回答:

①阳离子交换膜是指________(填“A”或“B”)。
②写出通电后阳极区的电极反应式________________。
(1)离子交换法 膜分离法
(2)2CN-+2ClO2=2CO2↑+N2↑+2Cl-
(3)软化 盐酸或酸
(4)①B ②2Cl--2e-=Cl2↑
(2)2CN-+2ClO2=2CO2↑+N2↑+2Cl-
(3)软化 盐酸或酸
(4)①B ②2Cl--2e-=Cl2↑
(1)水处理的核心是减少或处理水中的各种杂质,采用的主要方法是,离子交换法、膜分离法。
(2)ClO2具有强氧化性,CN-中的碳被氧化成CO2,氮容易被还原为N2,方程式为2CN-+2ClO2=2CO2↑+N2↑+2Cl-。
(3)地下水硬度很大,需要软化,则自来水有厂需要对地下水进行软化,阳离子交换树脂可以实现阳离子之间的交换,阴离子交换树脂交换出H+离子,生成CaR2,可用盐酸或酸溶液使阴离子交换树脂再生。
(4)①阴离子交换树脂只允许阴离子自由通过,阳离子交换树脂只允许阳离子自由通过,隔膜B和阴极相连,电解池阴极是阳离子放电,所以隔膜B是阳离子交换膜。②Cl-在电解池中的阳极放电,即2Cl-2e-=Cl2↑。
(2)ClO2具有强氧化性,CN-中的碳被氧化成CO2,氮容易被还原为N2,方程式为2CN-+2ClO2=2CO2↑+N2↑+2Cl-。
(3)地下水硬度很大,需要软化,则自来水有厂需要对地下水进行软化,阳离子交换树脂可以实现阳离子之间的交换,阴离子交换树脂交换出H+离子,生成CaR2,可用盐酸或酸溶液使阴离子交换树脂再生。
(4)①阴离子交换树脂只允许阴离子自由通过,阳离子交换树脂只允许阳离子自由通过,隔膜B和阴极相连,电解池阴极是阳离子放电,所以隔膜B是阳离子交换膜。②Cl-在电解池中的阳极放电,即2Cl-2e-=Cl2↑。

练习册系列答案
相关题目