题目内容
【题目】如图所示,烧杯内盛有浓硝酸,在烧杯内放入用导线连接的铁、铅两个电极,已知原电池停止工作时,Fe、Pb均有剩余。下列说法正确的是( )
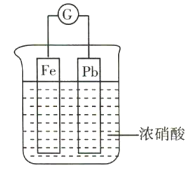
A.Fe比Pb活泼,故Fe始终作负极
B.Fe在浓硝酸中钝化,故始终不溶解
C.原电池停止工作时,溶液中有![]()
D.利用浓硝酸作电解质溶液不符合“绿色化学”的思想
【答案】D
【解析】
开始时,浓硝酸使铁发生钝化,铅失电子作负极,铁作正极,随着反应的进行,硝酸的浓度逐渐降低,而稀硝酸能溶解铁,所以铁作负极,铅作正极。
A.反应开始时,浓硝酸使铁发生钝化,铅失电子作负极,A错误;
B.随着反应的进行,硝酸的浓度逐渐降低,而稀硝酸能溶解铁,铁的活泼性比铅强,所以铁作负极,B错误;
C.原电池停止工作时铁有剩余,故溶液中不可能存在Fe3+,C错误;
D.利用浓硝酸作电解质溶液,正极的电极反应式为![]() ,有污染性气体二氧化氮生成,不符合“绿色化学”的思想,D正确;
,有污染性气体二氧化氮生成,不符合“绿色化学”的思想,D正确;
答案选D。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 用双氧水滴定KI-淀粉溶液 | 溶液变蓝 | 达到滴定终点 |
B | 向食用加碘盐中加入食醋和KI溶液,再加入CCl4振荡,静置 | 下层呈紫红色 | 该食用加碘盐中含有KIO3 |
C | 用湿润的淀粉碘化钾试纸鉴别NO2、溴蒸气 | 试纸变蓝 | 该气体为溴蒸气 |
D |
| 最后试管有浅黄色沉淀 | 有机物中含有溴原子 |
A. AB. BC. CD. D