题目内容
【题目】如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极. 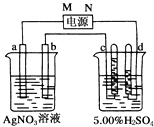
通电一段时间后,在c、d两极上共收集到336mL(标准状况)气体.回答:
(1)直流电源中,M为极.
(2)Pt电极上生成的物质是 , 其质量为g.
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:2::: .
(4)AgNO3溶液的浓度(填“增大”“减小”或“不变”.下同) , H2SO4溶液的浓度 .
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为g.
【答案】
(1)正
(2)Ag;2.16
(3)2;0.5;1
(4)不变;增大
(5)45.18
【解析】解:(1)根据题意知,电极a、b上没有气体生成,则活性电极Ag作阳极,即a作阳极,b为阴极,所以M为正极,所以答案是:正;
(2.)电解稀硫酸反应时,当通电一段时间后,c、d两极共收集到336mL气体(标准状况),则阴极发生2H++2e﹣═H2↑,阳极发生4OH﹣﹣4e﹣═O2↑+2H2O,实际上电解的是水,电池反应式为:2H2O ![]() 2H2↑+O2↑,根据方程式知,生成氢气的体积占总体积的
2H2↑+O2↑,根据方程式知,生成氢气的体积占总体积的 ![]() 所以混合气体中氢气的体积是224mL,根据2H++2e﹣═H2↑知,转移电子的物质的量是0.02mol,串联电解池中转移电子数相等,电镀池阴极上析出银的质量为
所以混合气体中氢气的体积是224mL,根据2H++2e﹣═H2↑知,转移电子的物质的量是0.02mol,串联电解池中转移电子数相等,电镀池阴极上析出银的质量为
Ag+ | + | e﹣ | = | Ag |
1mol | 108g | |||
0.02mol | 2.16g |
所以答案是:Ag;2.16g;
(3.)b电极上的电极反应式为:Ag++e﹣=Ag
C.电极上的电极反应式为:4OH﹣﹣4e﹣=2H2O+O2↑
d.电极上的电极反应式为:2H++2e﹣=H2↑假设转移电子的物质的量是2mol,则生成银2mol、生成氧气0.5mol、生成氢气1mol,所以所以电子的物质的量与电极b、c、d分别生成的物质的物质的量之比为:2:2:0.5:1,所以答案是:2;0.5;1;
(4.)在铂电极上镀银时,阳极上的电极反应式为Ag﹣e﹣=Ag+ , 阴极上的电极反应式为Ag++e﹣=Ag,电解稀硫酸溶液时,阴极发生2H++2e﹣═H2↑,导致稀硫酸的浓度减小,溶液的pH值增大;所以答案是:不变;增大;
(5.)设原5.00%的H2SO4溶液为xg,电解消耗水0.01×18=0.18g,则:5.00%x=5.02%(x﹣0.18),解得:x=45.18g.
所以答案是:45.18.

【题目】由ABCD四种金属按下表装置图进行实验.
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C极质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是;
(2)装置乙中正极的电极反应式是;
(3)装置丙中溶液的pH(填“变大”或“变小”或“不变”);
(4)四种金属活动性由强到弱的顺序是