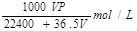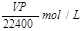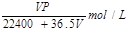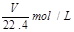题目内容
(1)将ag氯化钙溶于1.8L水中,恰好使钙离子数与水分子数之比为1:100,则a值为 。
(2)在反应2A+B=3C+2D中,已知3.4gA与3.2gB完全反应,生成4.8gC,又知道D的式量为18,则B的式量是
(3)25.4g 某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是 ;A的相对原子质量是 ;ACl2的化学式是 。
(4) 某混合物由Na2SO4、Al2(SO4)3组成,已知Na、Al两元素的质量之比为23: 9,则Na2SO4和Al2(SO4)3物质的量之比为 ,含1.00mol SO42–的该混合物的质量为 。
(2)在反应2A+B=3C+2D中,已知3.4gA与3.2gB完全反应,生成4.8gC,又知道D的式量为18,则B的式量是
(3)25.4g 某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是 ;A的相对原子质量是 ;ACl2的化学式是 。
(4) 某混合物由Na2SO4、Al2(SO4)3组成,已知Na、Al两元素的质量之比为23: 9,则Na2SO4和Al2(SO4)3物质的量之比为 ,含1.00mol SO42–的该混合物的质量为 。
(1)111
(2)64
(3)127g/mol 56 FeCl2
(4)3:1 128g
(2)64
(3)127g/mol 56 FeCl2
(4)3:1 128g
试题分析:(1)ag氯化钙含有钙离子的物质的量n(Ca2+)为a/111 mol。1.8L水含有水的质量m(H2O)为1.8L/1g/cm3=1800g。则物质的量n(H2O)=1800g/18g/mol=100mol。n(Ca2+):n(H2O)=1:100.所以a=111。
(2)根据质量守恒可知,生成D的质量为1.8g。则n(D)=1.8g/18g/mol=0.1mol,n(D):n(B)=2:1,所以n(B)=0.05mol。MB=3.2g/0.05mol=64g/mol。
(3)因氯化物ACl2中含有0.4molCl-可知,氯化物ACl2的物质的量为0.4mol/2=0.2mol,
则M(ACl2)=25.4g/0.2mol=127g/mol,所以ACl2相对分子质量为127,A的相对原子量为127-71=56,A为铁元素,ACl2的化学式FeCl2。
(4)设Na2SO4的物质的量为n1,Al2(SO4)3的物质的量为n2,则n(SO42-)= n1+3 n2Na、Al两元素的质量之比为23: 9,即(2 n1*23):(2 n2*27)=23:9。则两者的物质的量之比为n1: n2=3:1。若n1+3 n2=1.00mol,则n1=0.5mol, n2=1/6mol。所以混合物的质量为0.5mol*142g/mol+1/6mol*342g/mol=128g。

练习册系列答案
相关题目