题目内容
制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应实现:
①Si(s)+3HCl(g) ![]() SiHCl3(g)+H2(g),放热反应
SiHCl3(g)+H2(g),放热反应
②SiHCl3+H2![]() Si+3HCl
Si+3HCl
对以上两个反应的下列叙述中,错误的是( )
A.两个反应都是置换反应 B.反应②是放热反应
C.两个反应都是离子反应 D.两个反应都是氧化还原反应
BC
解析:
①中反应物是②中生成物,①中生成物是②中反应物,①反应和②反应是互为逆向进行的反应,①反应放热,则②反应吸热。同理,若①反应吸热,则②反应放热。两个反应都是置换反应。

①Si(s)+3HCl(g)
| 300℃ |
②SiHCl3(g)+H2(g)
| 1000-1100℃ |
对上述两个反应的叙述中,错误的是( )
| A、两个反应都是置换反应 |
| B、反应②是吸热反应 |
| C、两个反应互为可逆反应 |
| D、两个反应都是氧化还原反应 |
太阳能的开发和利用是21世纪的一个重要课题。
(1)利用储能介质储存太阳能的原理是:白天在太阳光照射下,某种盐熔化,吸收热量,晚间熔盐释放出相应能量,从而使室温得以调节。已知如下表数据:
| 盐 | 熔点/℃ | 熔化吸热/ kJ·mol-1 | 参考价格/元·千克-1 |
| CaCl2·6H2O | 29.0 | 37.3 | 780~850 |
| Na2SO4·10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4·12H2O | 36.1 | 100.1 | 1 600~2 000 |
| Na2S2O3·5H2O | 48.5 | 49.7 | 1 400~1 800 |
其中最适宜用作储能介质的是___________________。
A.CaCl2·6H2O B.Na2SO4·10H2O
C.Na2HPO4·12H2O D.Na2S2O3·5H2O
(2)制造太阳能电池需要高纯度的硅,工业上由粗硅制高纯硅常通过以下反应实现:
![]()
![]() 关于上述条件下两个反应的叙述中不正确的是______________。
关于上述条件下两个反应的叙述中不正确的是______________。
A.两个反应都是置换反应
B.反应①是放热反应
C.上述反应是可逆反应
D.两个反应都是氧化还原反应、
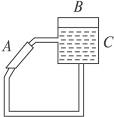
(3)右图是一种太阳能热水器的示意图,阳光照射到太阳能集热器上,将太阳能转化,图中A是集热器,B是储水容器,C是供阴天时加热的辅助电热器。根据你对水的密度的认识,你估计阳光照射下水将沿________________(填“顺”或“逆”)时针方向流动。
制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应实现( )
|

②
对上述两个反应的下列叙述中,错误的是
A. 两个反应都是置换反应 B. 两个反应都是氧化还原反应
C. 两个反应互为可逆反应 D. 反应②是放热反应
 SiHCl3(g)+H2(g) +381 kJ
SiHCl3(g)+H2(g) +381 kJ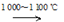 Si(s)+3HCl(g)
Si(s)+3HCl(g)