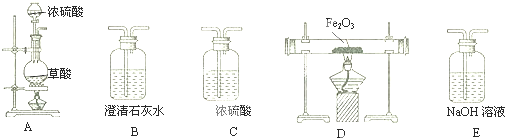
题目内容
18. 某工厂废水中含游离态氯,通过下列实验测定其浓度
某工厂废水中含游离态氯,通过下列实验测定其浓度①取水样10.0mL于锥形瓶,加入10.0mLKI溶液(足量),滴入指示剂2-3滴.
②取一滴定管依次用自来水,蒸馏水洗净,然后注入0.01mol•L-1的Na2S2O3溶液,调整液面,记下读数.
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+Na2S4O6.
试回答下列问题:
(1)步骤①加入的指示剂是淀粉溶液.
(2)取水样应使用A滴定管(填A或B).
如果滴定管A内部有气泡,赶走气泡的操作是快速放液
(3)步聚③当待测液由蓝色变为无色且30s不再变化即达终点,若耗去Na2S2O3溶液20.00mL,则废水中C12的物质的量浓度为0.01mol/L.
(4)Cl2的实际浓度比所测浓度应偏大(填“偏大”、“偏小”或“相等”),造成误差的原因是因为步骤②滴定管用蒸馏水洗净后未用标准液(Na2S2O3溶液)润洗,测出的c(Cl2)大于实际浓度.
(1)淀粉溶液;(2)A;快速放液(3)蓝,无,0.01mol•L-1;(4)偏小,步骤②滴定管用蒸馏水洗净后未用待测液润洗,故测出的c(Cl2)大于实际浓度.
分析 (1)碘遇淀粉溶液变蓝色,当完全反应时,溶液褪色;
(2)废水中含游离态氯,有氧化性,所以取水样应使用酸式滴定管;要赶净酸式滴定管尖嘴部分的气泡,最有效的方法就是快速放液;
(3)溶液呈蓝色,随反应I2+2Na2S2O3=2NaI+2Na2S4O6进行,溶液中没有碘,溶液由蓝色为无色;结合化学方程式定量关系计算得到;
(4)根据碱式滴定管未用Na2S2O3溶液润洗,使得Na2S2O3溶液浓度偏小.
解答 解:(1)溶液中有单质碘,加入淀粉溶液呈蓝色,碘与亚硫酸钠发生氧化还原反应,当反应终点时,蓝色褪去,故答案为:淀粉溶液;
(2)废水中含游离态氯,有氧化性,所以取水样应使用酸式滴定管,故选A;要赶净酸式滴定管尖嘴部分的气泡,最有效的方法就是快速放液,
故答案为:A;快速放液;
(3)碘遇淀粉变蓝色,所以溶液呈蓝色,随反应I2+2Na2S2O3=2NaI+2Na2S4O6进行,溶液中没有碘,溶液由蓝色为无色,说明反应到终点,判断达到滴定终点的实验现象是:滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色;Cl2+2I-=2Cl-+I2:I2+2Na2S2O3=2NaI+Na2S4O6.
Cl2~2Na2S2O3
1 2
n 0.01mol•L-1×0.0200L
n=0.0001mol
c(Cl2)=$\frac{0.0001mol}{0.0100L}$=0.01mol/L;
故答案为:蓝;无;0.01mol/L;
(4)碱式滴定管未用Na2S2O3溶液润洗,使得Na2S2O3溶液浓度偏小,消耗的Na2S2O3溶液体积偏大,测得I2的物质的量偏多,则游离态氯的浓度偏大,即氯的实际浓度比所测浓度会偏小;
故答案为:偏大;因为步骤②滴定管用蒸馏水洗净后未用标准液(Na2S2O3溶液)润洗,测出的c(Cl2)大于实际浓度.
点评 本题考查了氧化还原滴定、中和反应滴定误差分析,注意掌握氧化还原滴定的原理和方法是解题的关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 1molFe与足量稀盐酸反应时,转移电子的数目为3NA | |
| B. | 标准状况下,22.4LN2和H2混合气中含NA个原子 | |
| C. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| D. | 数目为NA的一氧化碳分子和0.5mol甲烷的质量比为7:4 |
| A. | 1mol气体的体积只有在标准状况下才约是22.4L | |
| B. | 等质量的N2和N4,在不同条件下,所含氮原子数不同 | |
| C. | 22g某气体含分子数为0.5NA,则其摩尔质量为44 | |
| D. | 标准状况下1.12L CO和N2的混合气体含有约6.02×1022个原子 |
| 实验项目 | 实验现象 |
| FeCl3溶液中加入维生素C(Vc) | 溶液褪为浅绿色 |
| Fe(OH)3胶体通直流电 | 阴极附近红褐色加深 |
| 将铜锈放入盐酸中 | 有无色气泡产生 |
| A. | 维生素C(Vc)具有还原性 | B. | Fe(OH)3胶体粒子带正电荷 | ||
| C. | 铜锈与盐酸反应一定有CO2生成 | D. | 铜锈中可能含有碳酸根 |
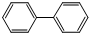 )下列有关联苯的说法中正确的是( )
)下列有关联苯的说法中正确的是( )| A. | 分子中含有6个碳碳双键 | |
| B. | 1mol联苯最多可以和6molH2发生加成反应 | |
| C. | 它可以发生加成反应、取代反应,不易被酸性高锰酸钾氧化 | |
| D. | 它和蒽(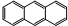 )同属于芳香烃,两者互为同系物 )同属于芳香烃,两者互为同系物 |