题目内容
17.下列说法正确的是( )| A. | 标准状况下,22.4 L N2和O2的混合气体中含有的分子数为NA | |
| B. | 常温常压下,11.2 L二氧化硫中所含的氧原子数等于NA | |
| C. | 标准状况下,80 g SO3中含3NA个氧原子,体积约为22.4 L | |
| D. | 足量Zn与一定量的浓硫酸反应,产生22.4 L气体时,转移的电子数一定为2NA |
分析 A、标准状况下,22.4 L N2和O2的混合气体物质的量为1mol,根据N=nNA;
B、常温常压下气体摩尔体积大于22.4L/mol;
C、标况下,三氧化硫为固体;
D、足量Zn与一定量的浓硫酸反应,浓硫酸产生二氧化硫,变稀后产生氢气,分析两种情况下产生气体的物质的量和转移电子数的关系.
解答 解:A、标准状况下,22.4 L N2和O2的混合气体物质的量为1mol,所以分子数为NA,故A正确;
B、常温常压下气体摩尔体积大于22.4L/mol,故11.2L二氧化硫的物质的量小于0.5mol,则含有的氧原子小于1mol即NA个,故B错误;
C、标况下,三氧化硫为固体,故其体积不能根据气体摩尔体积来计算,故C错误;
D、浓硫酸与锌反应产生气体为二氧化硫,每生成1molSO2转移2mol电子,稀硫酸与锌反应产生氢气,每生成1molH2转移2mol电子,标况下,22.4L气体的物质的量为1mol,故足量Zn与一定量的浓硫酸反应,产生22.4L(标况)气体时,转移的电子数为2NA,但状况不知,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的正误判断.做此类题目要注意审题,综合考虑物质的结构、性质,物质的量与质量、体积、浓度、氧化还原反应等的关系.

练习册系列答案
相关题目
7.设NA表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下22.4LH2O中含分子数为NA | |
| B. | 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| C. | 常温常压下,1mol氦气含有2NA个原子 | |
| D. | 1molHCl气体溶于1L水中形成的盐酸中含有NA个HCl分子 |
8.下列烷烃的系统命名中,错误的是( )
| A. | 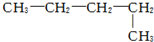 戊烷 戊烷 | B. | 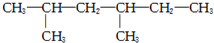 2,4-甲基乙烷 2,4-甲基乙烷 | ||
| C. | 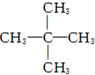 2,2-二甲基丙烷 2,2-二甲基丙烷 | D. |  4-甲基戊烷 4-甲基戊烷 |
12.下列物质中属于电解质的是( )
| A. | 氯化氢 | B. | 酒精 | C. | 三氧化硫 | D. | 铁 |
9.下列反应中,可用离子方程式CO32-+2H+=CO2↑+H2O表示的是( )
| A. | CaCO3和足量盐酸反应 | |
| B. | Na2CO3溶液和足量醋酸(CH3COOH)反应 | |
| C. | Na2CO3溶液和足量稀硝酸反应 | |
| D. | NaHCO3溶液和足量稀硫酸反应 |
6.设NA为阿伏加德罗常数的值.下列叙述不正确的是( )
| A. | 标准状况下,0.56L丙烷中含有共价键的数目为2.5NA | |
| B. | 常温常压下,6.4g氧气和臭氧的混合气体中含有的原子总数为0.4NA | |
| C. | 5.6g铁与一定量浓硫酸恰好反应,转移的电子数目可能为0.2NA | |
| D. | 常温下,20 L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA |
7.为实现下列实验目的,依据下表提供的主要仪器,所用试剂合理的是( )
| 选项 | 实验目的 | 主要玻璃仪器 | 试剂 |
| A | 分离乙醇和乙酸混合物 | 蒸馏烧瓶、冷凝管、酒精灯、温度计、锥形瓶 | 乙醇和乙酸混合物 |
| B | 鉴别NH4Cl中的阳离子 | 试管、酒精灯 | NH4Cl、红色石蕊试纸、蒸馏水 |
| C | 实验室制取CO2 | 试管、带导管的橡皮塞 | 大理石、稀H2SO4 |
| D | 测定FeSO4溶液浓度 | 滴定管、锥形瓶、烧杯 | FeSO4溶液、0.1000mol•L-1KMnO4 |
| A. | A | B. | B | C. | C | D. | D |
 .
.