题目内容
X+,Y-,Z-是三种主族元素的离子X+,Y-,Z-是三种主族元素的离子.X+和Y-具有相同的电子层结构,X和Z原子核外电子层数相同,Z-的还原性比Y-的强,则X,Y,Z三种元素的核电荷数关系是
- A.X>Y>Z
- B.Z>Y>X
- C.Z>X>Y
- D.Y>X>Z
C
导解:由题意可知X原子序数比Y大,X易失电子,Z可得一个电子知Z非金属性比X强,故Z的原子序数大于X导解:由题意可知X原子序数比Y大,X易失电子,Z可得一个电子知Z非金属性比X强,故Z的原子序数大于X.由Z-的还原性大于Y-可知Z的非金属性小于Y,故Z的原子序数比Y大.故原子序数大小顺序为Z>X>Y.
导解:由题意可知X原子序数比Y大,X易失电子,Z可得一个电子知Z非金属性比X强,故Z的原子序数大于X导解:由题意可知X原子序数比Y大,X易失电子,Z可得一个电子知Z非金属性比X强,故Z的原子序数大于X.由Z-的还原性大于Y-可知Z的非金属性小于Y,故Z的原子序数比Y大.故原子序数大小顺序为Z>X>Y.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2009?南京二模)X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的转化关系,下列说法正确的是( )
(2009?南京二模)X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的转化关系,下列说法正确的是( )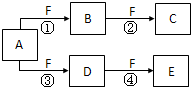 (2011?海淀区二模)X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.回答下列问题:
(2011?海淀区二模)X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.回答下列问题:
