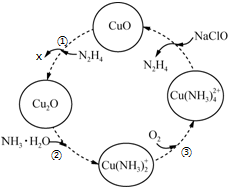
题目内容
3.某温度下反应H2(g)+I2(g)?2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2mol•L-1H2(g)、0.5mol•L-1 I2(g)及0.3mol•L-1 HI(g),则下列说法中正确的是( )| A. | 反应总体向左进行 | |
| B. | 反应达到平衡时,H2的物质的量分数<50% | |
| C. | 反应向某方向进行一段时间后K<57.0 | |
| D. | 反应达到平衡时,H2的转化率为75% |
分析 A.计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行;
B.向左进行建立平衡时,氢气的浓度增大,氢气最大浓度应小于(0.2mol/L+0.15mol/L)=0.35mol/L,向右反应建立平衡,平衡时氢气浓度小于0.2mol/L,混合气体总浓度不变,氢气物质的量分数=$\frac{氢气平衡浓度}{混合气体总浓度}$×100%;
C.平衡常数只受温度影响,温度不变,平衡常数不变;
D.假设氢气转化率为75%,计算各物质的浓度,再计算浓度商Qc,若Qc=K,处于平衡状态,则平衡时氢气转化率为75%.
解答 解:A.浓度商Qc=$\frac{0.{3}^{2}}{0.2×0.5}$=0.9<K=57,反应向正反应进行,故A错误;
B.反应向右进行建立平衡,故平衡时氢气浓度小于0.2mol/L,混合气体总浓度不变,平衡时氢气物质的量分数<$\frac{0.2mol/L}{(0.2+0.5+0.3)mol/L}$×100%=20%,故B正确;
C.平衡常数只受温度影响,由于温度不变,平衡常数不变,故C错误;
D.假设氢气转化率为75%,则氢气浓度变化量为0.2mol/L×75%=0.15mol/L,则:
H2(g)+I2(g)?2HI(g)
开始浓度(mol/L):0.2 0.5 0.3
变化浓度(mol/L):0.15 0.15 0.3
氢气转化率为75%时(mol/L:0.05 0.35 0.6
浓度商Qc=$\frac{0.{6}^{2}}{0.05×0.35}$=20.6<K=57.0,故氢气转化率为75%时反应未到达平衡,反应向正反应进行,平衡时氢气转化率大于75%,故D错误,
故选:B.
点评 本题考查化学平衡计算,涉及平衡常数计算及应用,B、D选项可以利用平衡常数计算具体的值,但计算量很大,侧重考查是分析计算能力、对知识的灵活运用能力,难度中等.

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案| A. | Na+与Cl-之间的离子键 | B. | 水分子间的氢键 | ||
| C. | 水分子内的共价键 | D. | 上述所有作用力 |
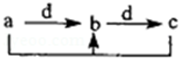 下表各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
下表各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )物质 选项 | a | b | c | d |
| A | C | CO | CO2 | O2 |
| B | Ca(OH)2 | CaCO3 | Ca(HCO3)2 | CO2 |
| C | Al | Al(OH)3 | NaAlO2 | NaOH |
| D | Cl2 | FeCl3 | FeCl2 | Fe |
| A. | A | B. | B | C. | C | D. | D |
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
| A. | 氯酸钾分解 | B. | 氢气还原氧化铜 | ||
| C. | 浓硫酸的稀释 | D. | 铝片与浓盐酸的反应 |
| A. | 乙烯的结构简式C2H4 | B. | 乙醇的分子式C2H6O | ||
| C. | 四氯化碳的电子式  | D. | 高锰酸钾的分子式K2MnO4 |
| A. | 丙炔:CH≡C-CH3 | |
| B. | 丙烯:CH2CHCH3 | |
| C. | 2丁烯的结构简式为CH3CH═CHCH3,其键线式为 | |
| D. | 乙醇:CH3CH2OH |