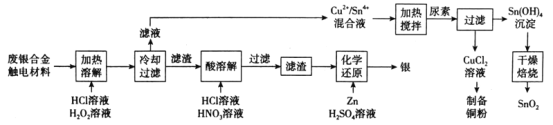
题目内容
【题目】在一个2L的密闭容器中,投入反应物,发生反应2SO3(g)![]() 2SO2(g)+O2(g) ΔH>0,其中SO3的变化如下图所示:
2SO2(g)+O2(g) ΔH>0,其中SO3的变化如下图所示:
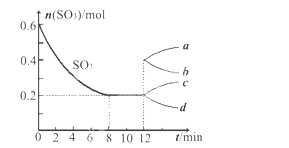
(1)写出该反应的平衡常数表达式并根据8min时到达平衡计算出结果________________。
(2)用O2表示0到8min内该反应的平均速率v=__________________。
(3)升高温度,该反应的K值将______;容器中气体的平均相对分子质量将______。(填“增大”“减小”或“不变”)
(4)能说明该反应已达到平衡状态的是________。
A.v(SO3)=2v(O2) B.容器内压强保持不变
C.v(SO2)逆=2v(O2)正 D.容器内密度保持不变
(5)在第12min时,容器压缩到1L,则SO3的变化曲线为_______。
A.a B.b C.c D.d
(6)若保持容积不变在第12min时,加入SO3(g),则平衡向_______反应方向移动(填“正” 或“逆”)。SO3的体积分数_______(填“增大”或“减小”)。
(7)将相同物质的量的SO3充入下面的两个容器中,已知甲容器有活塞可以上下移动,乙容器体积固定,在相同的温度、压强下开始发生反应,在反应过程中维持体系温度不变。

①反应达平衡所需时间甲________乙(填“大于”“等于”或“小于”);达平衡时SO3的转化率甲__________乙(“大于”“等于”或“小于”)。
②若平衡后,向甲、乙中分别充入惰性气体,__________(填“甲”或“乙”)容器的平衡将向__________(填“正”或“逆”)反应方向移动。
【答案】K=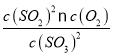 =0.4 0.0125 mol∕(L·min) 增大 减小 BC C 正 增大 大于 大于 甲 正
=0.4 0.0125 mol∕(L·min) 增大 减小 BC C 正 增大 大于 大于 甲 正
【解析】
(1)平衡常数等于生成物浓度系数次方的乘积与反应物的浓度系数次方的乘积之比;
(2)v(O2)=![]() ;
;
(3)升高温度,2SO3(g)![]() 2SO2(g)+O2(g) ΔH>0,平衡正向移动;气体总质量不变、总物质的量增大;
2SO2(g)+O2(g) ΔH>0,平衡正向移动;气体总质量不变、总物质的量增大;
(4)根据平衡标志分析;
(5)容器压缩的瞬间,SO3物质的量不变,随即平衡逆向移动,SO3的物质的量增大。
(6)若保持容积不变在第12min时,加入SO3(g),SO3浓度增大;体系压强增大;
(7)2SO3(g)![]() 2SO2(g)+O2(g),正反应气体物质的量增多,甲容器有活塞可以上下移动,乙容器体积固定,所以乙容器的压强大于甲。
2SO2(g)+O2(g),正反应气体物质的量增多,甲容器有活塞可以上下移动,乙容器体积固定,所以乙容器的压强大于甲。
(1)根据图像,8分钟时c(SO3)=0.2mol÷2L=0.1mol/L,则c(SO2)=0.2mol/L,c(O2)=0.1mol/L, K=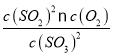 =
=![]() 0.4;
0.4;
(2)0到8min内生成氧气的物质的量是0.2mol,该反应的平均速率v(O2)=![]() 0.0125 mol∕(L·min);
0.0125 mol∕(L·min);
(3)升高温度,2SO3(g)![]() 2SO2(g)+O2(g) ΔH>0,平衡正向移动,所以K值将增大;气体总质量不变、总物质的量增大,M=m÷n,所以容器中气体的平均相对分子质量将减小;
2SO2(g)+O2(g) ΔH>0,平衡正向移动,所以K值将增大;气体总质量不变、总物质的量增大,M=m÷n,所以容器中气体的平均相对分子质量将减小;
(4)A.v(SO3)=2v(O2),都是正反应速率,不能体现正逆反应速率相等,故不一定平衡,不选A;
B.反应前后气体系数和不同,气体压强是变量,容器内压强保持不变一定平衡,故选B;
C.v(SO2)逆=2v(O2)正,正逆反应速率相等,一定平衡,故选C;
D.气体总质量不变、容器总体积不变,密度是恒量,容器内密度保持不变,不一定平衡,故不选D。
(5)容器压缩的瞬间,SO3物质的量不变,随即平衡逆向移动,SO3的物质的量增大,所以c曲线符合。
(6)若保持容积不变在第12min时,加入SO3(g),SO3浓度增大,平衡正向移动;体系压强增大,SO3的体积分数增大;
(7)2SO3(g)![]() 2SO2(g)+O2(g),正反应气体物质的量增多,甲容器有活塞可以上下移动,乙容器体积固定,所以平衡时乙容器的压强大于甲;
2SO2(g)+O2(g),正反应气体物质的量增多,甲容器有活塞可以上下移动,乙容器体积固定,所以平衡时乙容器的压强大于甲;
①压强越大反应速率越快,乙容器的压强大于甲,所以达到平衡所需时间甲大于乙;增大压强平衡逆向移动,达平衡时SO3的转化率甲大于乙。
②若平衡后,向甲、乙中分别充入惰性气体,甲容器体积增大,相当于减压,平衡将向正反应方向移动。充入惰性气体后乙容器体积不变,平衡不移动。