题目内容
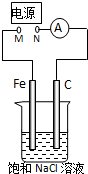
如图所示,将纯Fe棒和石墨棒插入1L 饱和NaCl溶液中.下列说法正确的是( )
A.去掉电源,将M、N用导线直接相连,则Fe棒上产生气泡
B.M连接电源正极,N连接电源负极,则Fe棒被保护不会溶解
C.M连接电源负极,N连接电源正极,当两极产生气体总量为 22.4mL(标准状况)时,则生成0.001mol NaOH
D.M连接电源负极,N连接电源正极,如果把烧杯中的溶液换成1L CuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀
【答案】分析:A.去掉电源,该装置是原电池,铁发生吸氧腐蚀,铁棒上失电子发生氧化反应;
B.M连接电源正极,N连接负极,则该装置是电解池,铁作阳极,石墨作阴极,铁被腐蚀;
C.M连接电源负极,N连接正极,该装置是电解池,铁作阴极,石墨作阳极,根据电池反应式计算生成氢氧化钠的量;
D.M连接电源负极,N连接正极,该装置是电解池,铁作阴极,石墨作阳极,阳极上析出氧气,阴极上析出铜.
解答:解:A.去掉电源,该装置是原电池,铁发生吸氧腐蚀,铁棒上的电极反应式为:Fe-2e-=Fe2+,故A错误;
B.M连接电源正极,N连接负极,则该装置是电解池,铁作阳极,石墨作阴极,铁棒上的电极反应式为:Fe-2e-=Fe2+,所以铁被腐蚀,故B错误;
C.M连接电源负极,N连接正极,该装置是电解池,铁作阴极,石墨作阳极,电池反应式为:
2NaCl+2H2O (Cl2 ↑+H2↑)+2NaOH
(Cl2 ↑+H2↑)+2NaOH
44.8L 2mol
0.0224L 0.001mol
所以当两极产生气体总量为 22.4mL(标准状况)时,则生成0.001mol NaOH,故C正确;
D.M连接电源负极,N连接正极,该装置是电解池,铁作阴极,石墨作阳极,电池反应式为:2CuSO4+2H2O 2H2SO4+O2↑+2Cu,溶液呈酸性,所以没有蓝色沉淀生成,故D错误;
2H2SO4+O2↑+2Cu,溶液呈酸性,所以没有蓝色沉淀生成,故D错误;
故选C.
点评:本题考查电解池和原电池原理,明确离子放电顺序是解本题关键,注意电解池中如果活泼金属作阳极,则阳极上金属电极失电子而不是溶液中阴离子失电子,为易错点.
B.M连接电源正极,N连接负极,则该装置是电解池,铁作阳极,石墨作阴极,铁被腐蚀;
C.M连接电源负极,N连接正极,该装置是电解池,铁作阴极,石墨作阳极,根据电池反应式计算生成氢氧化钠的量;
D.M连接电源负极,N连接正极,该装置是电解池,铁作阴极,石墨作阳极,阳极上析出氧气,阴极上析出铜.
解答:解:A.去掉电源,该装置是原电池,铁发生吸氧腐蚀,铁棒上的电极反应式为:Fe-2e-=Fe2+,故A错误;
B.M连接电源正极,N连接负极,则该装置是电解池,铁作阳极,石墨作阴极,铁棒上的电极反应式为:Fe-2e-=Fe2+,所以铁被腐蚀,故B错误;
C.M连接电源负极,N连接正极,该装置是电解池,铁作阴极,石墨作阳极,电池反应式为:
2NaCl+2H2O
 (Cl2 ↑+H2↑)+2NaOH
(Cl2 ↑+H2↑)+2NaOH44.8L 2mol
0.0224L 0.001mol
所以当两极产生气体总量为 22.4mL(标准状况)时,则生成0.001mol NaOH,故C正确;
D.M连接电源负极,N连接正极,该装置是电解池,铁作阴极,石墨作阳极,电池反应式为:2CuSO4+2H2O
 2H2SO4+O2↑+2Cu,溶液呈酸性,所以没有蓝色沉淀生成,故D错误;
2H2SO4+O2↑+2Cu,溶液呈酸性,所以没有蓝色沉淀生成,故D错误;故选C.
点评:本题考查电解池和原电池原理,明确离子放电顺序是解本题关键,注意电解池中如果活泼金属作阳极,则阳极上金属电极失电子而不是溶液中阴离子失电子,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2010?南开区一模)如图所示,将纯Fe棒和石墨棒插入1L 饱和NaCl溶液中.下列说法正确的是( )
(2010?南开区一模)如图所示,将纯Fe棒和石墨棒插入1L 饱和NaCl溶液中.下列说法正确的是( )