题目内容
13.用于分离或提纯物质的方法有:A.蒸馏(分馏) B.萃取C.过滤 D.重结晶 E.分液.下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(请在横线上填方法的标号)(1)分离四氯化碳与水的混合物E
(2)分离汽油和煤油A
(3)分离碘水中的碘单质B
(4)提纯氯化钠和硝酸钾混合物中的硝酸钾D.
分析 (1)对应分层的液体,利用分液法分离;
(2)相互溶解的液体,沸点不同,利用蒸馏法分离;
(3)碘在水中的溶解度小,在有机物中的溶解度大,可利用萃取法分离;
(4)氯化钠的溶解度受温度影响不大,而硝酸钾的溶解度受温度影响大,可利用重结晶法分离.
解答 解:(1)四氯化碳与水分层,则选择分液法分离,故答案为:E;
(2)汽油和煤油相互溶解体,但沸点不同,则选择蒸馏法分离,故答案为:A;
(3)碘在水中的溶解度小,在有机物中的溶解度大,分离碘水中的碘单质,则选择萃取法分离,故答案为:B;
(4)氯化钠的溶解度受温度影响不大,而硝酸钾的溶解度受温度影响大,所以提纯氯化钠和硝酸钾混合物中的硝酸钾,选择重结晶法分离,故答案为:D.
点评 本题考查混合物的分离、提纯,为高频考点,侧重于学生的分析、实验能力的考查,明确常见混合物的分离方法及使用条件是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
3.下列离子方程式书写正确的是( )
| A. | 醋酸溶液与烧碱溶液的反应:OH-+H+═H2O | |
| B. | 往石灰乳中通入过量的CO2:OH-+CO2═HCO3- | |
| C. | 用氢氧化钠溶液吸收足量二氧化碳 OH-+CO2═HCO3- | |
| D. | 沸水中滴入FeCl3饱和溶液:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3+3H+ |
8.下列说法中正确是( )
| A. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| B. | 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 | |
| C. | 废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
18.下列说法正确的是( )
| A. | 苯和乙烯均含有碳碳双键,均可使溴的CCl4溶液褪色 | |
| B. | 苯( )的一氯代物有一种,丙烷的一氯代物也有一种 )的一氯代物有一种,丙烷的一氯代物也有一种 | |
| C. | 乙醇和乙烯均可与酸性高锰酸钾发生反应 | |
| D. | 蔗糖和麦芽糖互为同分异构体,纤维素和淀粉也互为同分异构体 |
2.下列关于热化学方程式和反应的热效应的叙述中,正确的是( )
| A. | 已知2C(s)+2O2(g)═2CO2(g);△H1,2C(s)+O2(g)=2CO(g);△H2.则△H1<△H2 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)?$?_{500℃,30MPa}^{催化剂}$2MH3(g),△H=-38.6kJ•mol-1 | |
| C. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol | |
| D. | 已知2H2(g)+O2(g)═2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
 )是一种重要的化工原料,
)是一种重要的化工原料,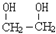 (g)△H=a kJ/mol
(g)△H=a kJ/mol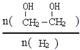 增大的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来.(写两条)
增大的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来.(写两条)