题目内容
某研究性学习小组设计两套实验方案制备氨气并探究其还原性(部分夹持装置已省略)。
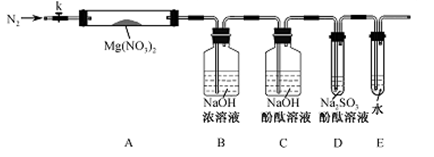
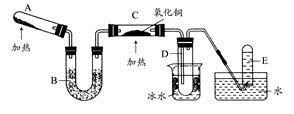
甲方案:如图所示。
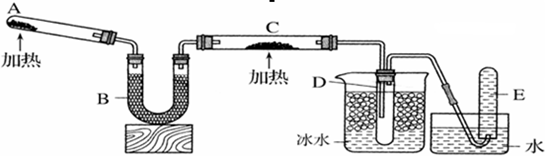
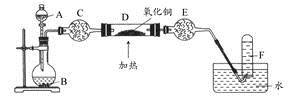
乙方案:如图所示。
根据方案回答下列问题:
(一)甲方案
(1)B装置盛装碱石灰,A装置中药品可以是 。
a.氯化铵固体和烧碱 b.碳酸氢铵固体
c.氯化铵固体 d.硫酸铵和熟石灰
(2)实验完毕后,设计简单实验检验D试管收集到的物质(简述操作过程、现象和结论) 。
(3)写出C中发生反应的化学方程式 。
(二)乙方案
(4)A为浓氨水,B为生石灰,简述实验原理: 。E装置里盛装的药品是 。
(5)能证明氨气具有还原性的实验现象 。(任写两条)
(6)铜有+2价、+1价、0价,根据氧化还原反应原理,D玻璃管里还原产物除铜外,还可能有 ,假设有铜以外的还原产物生成,写出D中发生反应的化学方程式: 。
甲方案:如图所示。

乙方案:如图所示。

根据方案回答下列问题:
(一)甲方案
(1)B装置盛装碱石灰,A装置中药品可以是 。
a.氯化铵固体和烧碱 b.碳酸氢铵固体
c.氯化铵固体 d.硫酸铵和熟石灰
(2)实验完毕后,设计简单实验检验D试管收集到的物质(简述操作过程、现象和结论) 。
(3)写出C中发生反应的化学方程式 。
(二)乙方案
(4)A为浓氨水,B为生石灰,简述实验原理: 。E装置里盛装的药品是 。
(5)能证明氨气具有还原性的实验现象 。(任写两条)
(6)铜有+2价、+1价、0价,根据氧化还原反应原理,D玻璃管里还原产物除铜外,还可能有 ,假设有铜以外的还原产物生成,写出D中发生反应的化学方程式: 。
(1)bd (2)用玻璃棒蘸取D中液体滴在红色石蕊试纸上,试纸变蓝,证明D中收集的是氨水 (3)3CuO+2NH3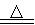 N2+3Cu+3H2O (4)生石灰溶于水放出大量的热,氨气在水中的溶解度随温度的升高而减小,生石灰与水反应,消耗水,减少了氨水中的溶剂,故生石灰与浓氨水混合产生大量氨气;无水硫酸铜 (5)D玻璃管中的黑色粉末变成红色,玻璃管壁有水珠;E中无水硫酸铜粉末由白色变为蓝色;F中收集到一定量气体等 (6)Cu2O;4CuO+2NH3=Cu2O+2Cu+N2+3H2O
N2+3Cu+3H2O (4)生石灰溶于水放出大量的热,氨气在水中的溶解度随温度的升高而减小,生石灰与水反应,消耗水,减少了氨水中的溶剂,故生石灰与浓氨水混合产生大量氨气;无水硫酸铜 (5)D玻璃管中的黑色粉末变成红色,玻璃管壁有水珠;E中无水硫酸铜粉末由白色变为蓝色;F中收集到一定量气体等 (6)Cu2O;4CuO+2NH3=Cu2O+2Cu+N2+3H2O
 N2+3Cu+3H2O (4)生石灰溶于水放出大量的热,氨气在水中的溶解度随温度的升高而减小,生石灰与水反应,消耗水,减少了氨水中的溶剂,故生石灰与浓氨水混合产生大量氨气;无水硫酸铜 (5)D玻璃管中的黑色粉末变成红色,玻璃管壁有水珠;E中无水硫酸铜粉末由白色变为蓝色;F中收集到一定量气体等 (6)Cu2O;4CuO+2NH3=Cu2O+2Cu+N2+3H2O
N2+3Cu+3H2O (4)生石灰溶于水放出大量的热,氨气在水中的溶解度随温度的升高而减小,生石灰与水反应,消耗水,减少了氨水中的溶剂,故生石灰与浓氨水混合产生大量氨气;无水硫酸铜 (5)D玻璃管中的黑色粉末变成红色,玻璃管壁有水珠;E中无水硫酸铜粉末由白色变为蓝色;F中收集到一定量气体等 (6)Cu2O;4CuO+2NH3=Cu2O+2Cu+N2+3H2O本实验的目的是制备氨气,并探究氨气的还原性。实验流程为:
(1)烧碱的碱性强,在加热时易腐蚀试管。碳酸氢铵分解生成氨气、二氧化碳和水,用碱石灰吸收二氧化碳和水,能制取纯净的氨气。氯化铵固体分解生成氨气与氯化氢,而氯化氢和氨气在试管口附近遇冷会产生氯化铵,不能制取氨气。综上所述,在四组物质中,选择硫酸铵和熟石灰或碳酸氢铵制氨气较合适。(2)生成的水在D中凝结,未反应的NH3溶于水,故D中收集到的是氨水,E试管收集的气体是氮气。(3)氨气与灼热氧化铜反应生成铜、氮气、水。(4)生石灰溶于水放出大量的热,氨气在水中的溶解度随温度的升高而降低,且生石灰与水反应,消耗了水;E中盛装无水硫酸铜,用来检验产物水。(5)D中发生反应,实验现象有:D玻璃管中黑色粉末变成红色,玻璃管壁有水珠;E中无水硫酸铜粉末由白色变蓝色;F中收集到一定量的气体。(6)根据氧化还原反应原理,氨气与氧化铜反应,氮元素化合价由-3价升至0价,而+2价铜可以降至+1价、0价,即还原产物有氧化亚铜(红色)、铜(红色),化学方程式为4CuO+2NH3 Cu2O+N2+3H2O+2Cu。
Cu2O+N2+3H2O+2Cu。

(1)烧碱的碱性强,在加热时易腐蚀试管。碳酸氢铵分解生成氨气、二氧化碳和水,用碱石灰吸收二氧化碳和水,能制取纯净的氨气。氯化铵固体分解生成氨气与氯化氢,而氯化氢和氨气在试管口附近遇冷会产生氯化铵,不能制取氨气。综上所述,在四组物质中,选择硫酸铵和熟石灰或碳酸氢铵制氨气较合适。(2)生成的水在D中凝结,未反应的NH3溶于水,故D中收集到的是氨水,E试管收集的气体是氮气。(3)氨气与灼热氧化铜反应生成铜、氮气、水。(4)生石灰溶于水放出大量的热,氨气在水中的溶解度随温度的升高而降低,且生石灰与水反应,消耗了水;E中盛装无水硫酸铜,用来检验产物水。(5)D中发生反应,实验现象有:D玻璃管中黑色粉末变成红色,玻璃管壁有水珠;E中无水硫酸铜粉末由白色变蓝色;F中收集到一定量的气体。(6)根据氧化还原反应原理,氨气与氧化铜反应,氮元素化合价由-3价升至0价,而+2价铜可以降至+1价、0价,即还原产物有氧化亚铜(红色)、铜(红色),化学方程式为4CuO+2NH3
 Cu2O+N2+3H2O+2Cu。
Cu2O+N2+3H2O+2Cu。
练习册系列答案
相关题目