题目内容
【题目】简答下面有关标准氢氧化钠溶液滴定待测盐酸的问题。
(1)盛放待测盐酸的锥形瓶下方垫一张白纸的作用是 。
(2)用酚酞作指示剂,滴定到达终点时,溶液的颜色变化是 。
(3)有下列错误操作:
①碱式滴定管用蒸馏水洗净后,未经标准溶液润洗就注入标准氢氧化钠溶液;
②用酸式滴定管取用待测酸液前,尖嘴部分有气泡,取用过程中气泡消失;
③滴定前,读碱液体积时视线低于碱式滴定管中的液面;滴定后,读出碱液体积时,视线高于碱式滴定管中的液面;
④锥形瓶用待测酸液润洗两次。
哪些错误操作会使盐酸浓度的测定值偏低_____________________。
哪些错误操作会使盐酸浓度的测定值偏高_____________________。
(4)如果用甲基橙代替酚酞作指示剂,此时所得盐酸浓度测定值比用酚酞作指示剂测出的稍大还
是稍小_______________________。
【答案】(1)便于观察颜色变化,减少滴定误差
(2)由无色变为粉红色,并在半分钟内粉红色不褪去
(3)②③ ①④(4)稍小
【解析】
试题分析:(1)因锥形瓶下垫一张白纸使滴定终点颜色变化更明显,便于分辨;
(2)滴定时,锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色,可说明达到滴定终点;
(3)①碱式滴定管用蒸馏水洗净后,未经标准溶液润洗就注入标准氢氧化钠溶液,导致标准液体积偏大,根据c(待测)=![]() 分析,则c(待测)偏大;②用酸式滴定管取用待测酸液前,尖嘴部分有气泡,取用过程中气泡消失,待测液的物质的量偏小,导致标准液体积偏小,根据c(待测)=
分析,则c(待测)偏大;②用酸式滴定管取用待测酸液前,尖嘴部分有气泡,取用过程中气泡消失,待测液的物质的量偏小,导致标准液体积偏小,根据c(待测)=![]() 分析,则c(待测)偏小;③滴定后读碱液体积时,俯视碱式滴定管中的液面,导致标准液体积偏小,根据c(待测)=
分析,则c(待测)偏小;③滴定后读碱液体积时,俯视碱式滴定管中的液面,导致标准液体积偏小,根据c(待测)=![]() 分析,则c(待测)偏小;④锥形瓶用待测酸液润洗两次,待测液的物质的量偏大,导致标准液体积偏大,根据c(待测)=
分析,则c(待测)偏小;④锥形瓶用待测酸液润洗两次,待测液的物质的量偏大,导致标准液体积偏大,根据c(待测)=![]() 分析,则c(待测)偏大;
分析,则c(待测)偏大;
(4)甲基橙在酸性范围内变色,而酚酞在碱性范围内变色,所以如果用甲基橙代替酚酞做指示剂,消耗的标准氢氧化钠溶液体积偏小,根据c(待测)=![]() 分析,可知所得盐酸浓度的测定值偏低。
分析,可知所得盐酸浓度的测定值偏低。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
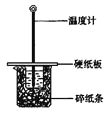
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 (填“偏大”、“偏小”、“无影响”,下同) 若用KOH代替NaOH,测定结果会 __ __
(5)他们记录的实验数据如下:
实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
t1 | t2 | ||||
① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | |
② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。