题目内容
【题目】磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解。
(1)已知:SO2(g) +Cl2(g)+ SCl2(g)![]() 2SOCl2(g) △H=a kJ·mol-1
2SOCl2(g) △H=a kJ·mol-1
SO2Cl2(g)+ SCl2(g)![]() 2SOCl2(g) △H=b kJ·mol-1
2SOCl2(g) △H=b kJ·mol-1
则反应:SO2(g) + Cl2(g)![]() SO2Cl2(g) △H =______kJ·mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K =______。
SO2Cl2(g) △H =______kJ·mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K =______。
(2)磺酰氯可与白磷发生反应为:P4+ 10SO2Cl2= 4PCl5+ 10SO2↑,若生成1molSO2,则转移电子的物质的量为_____mol。
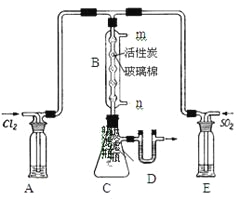
(3)某学习小组的同学依据反应:SO2(g)+ Cl2(g)![]() SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图。
SO2Cl2(g) △H <0,设计的制备磺酰氯装置如图。
![]()
![]()
①若用浓盐酸与二氧化锰为原料制取Cl2,其反应的化学方程式为_____。
②上图所示的装置说法正确的是_____(不定项选择)。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和Na2SO3溶液
b.B处反应管内五球中玻璃棉上的活性炭作催化剂
c.B处反应管冷却水应从m接口通入
d.装置C处吸滤瓶应放在冰水中冷却
e.D处U形管中盛放的可能是碱石灰
③从化学平衡移动角度分析,反应管通水冷却的目的为______。
(4)GET公司开发的Li-SO2Cl2军用电池,其示意图如图所示,
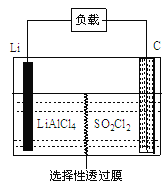
已知电池反应为:2Li + SO2Cl2=" 2LiCl" + SO2↑;则电池工作时,正极的电极反应式为_______。
【答案】a-b c(SO2Cl2)/[c(SO2)·c(Cl2)] 2 MnO2+4HCl(浓)![]() MnCl2+ Cl2↑ +2H2O bde 冷凝、降温均有利于SO2Cl2生成 SO2Cl2+ 2e- = 2Cl-+ SO2↑
MnCl2+ Cl2↑ +2H2O bde 冷凝、降温均有利于SO2Cl2生成 SO2Cl2+ 2e- = 2Cl-+ SO2↑
【解析】
试题(1)反应①SO2(g) +Cl2(g)+ SCl2(g)![]() 2SOCl2(g)减去反应②SO2Cl2(g)+ SCl2(g)
2SOCl2(g)减去反应②SO2Cl2(g)+ SCl2(g)![]() 2SOCl2(g)可得:SO2(g) + Cl2(g)
2SOCl2(g)可得:SO2(g) + Cl2(g)![]() SO2Cl2(g),根据盖斯定律可得△H =△H 1—△H2=(a-b)kl/mol;根据平衡常数的概念可得K= c(SO2Cl2)/[c(SO2)·c(Cl2)]。
SO2Cl2(g),根据盖斯定律可得△H =△H 1—△H2=(a-b)kl/mol;根据平衡常数的概念可得K= c(SO2Cl2)/[c(SO2)·c(Cl2)]。
(2)SO2Cl2中S元素的化合价为+6,SO2中S元素的化合价为+4,所以SO2Cl2转化为SO2,化合价降低2价,则SO2与电子转移的对应关系为:SO2~ 2e,所以生成1molSO2,转移电子的物质的量为2mol。
(3)①MnO2与浓盐酸加热生成MnCl2、Cl2、H2O,化学方程式为:MnO2+4HCl(浓)![]() MnCl2+ Cl2↑ +2H2O。
MnCl2+ Cl2↑ +2H2O。
②a、因为磺酰氯遇水发生剧烈水解,所以A、E两处洗气瓶的作用是干燥SO2、Cl2,盛放的干燥剂为浓硫酸,故a错误;b、B处反应管内五球中玻璃棉上的活性炭对氯气与二氧化硫的反应起到催化作用,故b正确;c、为了使气体充分冷却,B处反应管冷却水应从低处进高处出,即冷却水应从n接口通入,故c错误;d、SO2(g)+ Cl2(g)![]() SO2Cl2(g) △H <0,为放热反应,所以装置C处吸滤瓶放在冰水中冷却,降低温度,促进平衡向正反应方向移动,提高产物的产率,故d正确;e、因为磺酰氯遇水发生剧烈水解,所以D处盛放的是固体干燥剂,可能是碱石灰,故e正确。
SO2Cl2(g) △H <0,为放热反应,所以装置C处吸滤瓶放在冰水中冷却,降低温度,促进平衡向正反应方向移动,提高产物的产率,故d正确;e、因为磺酰氯遇水发生剧烈水解,所以D处盛放的是固体干燥剂,可能是碱石灰,故e正确。
③因为SO2(g)+ Cl2(g)![]() SO2Cl2(g) △H <0,为放热反应,所以反应管通水冷却能促使平衡向正反应方向移动,有利于SO2Cl2生成。
SO2Cl2(g) △H <0,为放热反应,所以反应管通水冷却能促使平衡向正反应方向移动,有利于SO2Cl2生成。
(4)电池工作时,正极上SO2Cl2发生得电子的反应,所以电极方程式为:SO2Cl2+ 2e- = 2Cl-+ SO2↑。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案