��Ŀ����
����Ŀ��ijУ��ѧѧϰС�����������ʵ����̽��Ԫ�������ɣ� һ��ͬѧΪ��֤±�ص��������Ե����ǿ��������ͼ��ʾװ�ý���ʵ�飨�г���������ȥ���������Ѽ��飩��
ʵ����̼�����
���ɼУ�����a���μ�Ũ���ᣮ
��B��C�е���Һ����Ϊ��ɫʱ���н����ɼУ�
��B����Һ�ɻ�ɫ��Ϊ�غ�ɫʱ���رջ���a��
��������b��������C����Һ����D�У��رջ���b��ȡ��D����
�ú�CCl4����Һ��Ϊ�Ϻ�ɫ��
��ش������й����⣺
��1����֤������������ǿ�ڵ��ʵ�������� ��
��2��B��C������ʢ�Ž���NaOH��Һ���������� ��
��3�����̢�ʵ���Ŀ���� ��
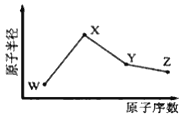
��4���ɴ�ʵ��ó��Ľ��ۣ�ͬ����Ԫ�ش��ϵ��£�ԭ�Ӱ뾶�����õ����������������������ǿ������
���𰸡�
��1�����۩�KI��ֽ����
��2������δ��Ӧ���������ɷ�ֹ��Կ�������Ⱦ
��3��ȷ��C�Ļ�ɫ��Һ����Cl2 �� �ų�Cl2�����û���ʵ��ĸ���
��4������
���������⣺��1�����۱���ɫ��˵���е��ʵ����ɣ�˵������������ǿ�ڵ��ʵ⣬���Դ��ǣ�����KI��ֽ��������2��B��C������ʢ�Ž���NaOH��Һ��������������δ��Ӧ���������ɷ�ֹ��Կ�������Ⱦ�����Դ��ǣ�����δ��Ӧ���������ɷ�ֹ��Կ�������Ⱦ����3��Ϊ��֤���������ǿ�ڵ⣬ʵ��ʱӦ���������ĸ��ţ���B����Һ�ɻ�ɫ��Ϊ�غ�ɫʱ��˵���д����������ɣ���ʱӦ�رջ���a����������������Ӱ��ʵ����ۣ����Դ��ǣ�ȷ��C�Ļ�ɫ��Һ����Cl2 �� �ų�Cl2�����û���ʵ��ĸ��ţ���4����ʵ���֪������������ǿ��Һ�壬��Һ���������ǿ�ڵⵥ�ʣ�����ͬ����Ԫ�ش��ϵ��£�ԭ�Ӱ뾶�����õ����������������Դ��ǣ�������
�����㾫�����������⣬������Ҫ�˽�ǽ�����Ԫ�����ڱ��е�λ�ü������ʵݱ�Ĺ���(��Ŀǰ��֪��112��Ԫ���У��ǽ���Ԫ����22�֣���H��ǽ���Ԫ�ض�λ�����ڱ������Ϸ���H�����Ϸ�����F�Ƿǽ�������ǿ��Ԫ��)��