题目内容
【题目】在相同条件下,分别将下列气体等体积混合于四支大小相同的试管中:①NO和NO2;②NO2和O2;③HCl和O2;④NH3和N2 , 将四支试管倒立于水中,当试管中水面不再上升时,试管中溶液的物质的量浓度最小的是(假设试管中溶质不扩散)( )
A.①
B.②
C.③
D.④
【答案】B
【解析】解:①发生反应:3NO2+H2O=2HNO3+NO,3体积二氧化氮反应生成1体积NO,溶液体积为2体积,则所得硝酸的浓度为 ![]() =
= ![]() mol/L;
mol/L;
②发生反应:4NO2+O2+2H2O=4HNO3 , 4体积二氧化氮反应消耗1体积氧气,剩余3体积氧气,溶液体积等于5体积,则所得硝酸的浓度为 ![]() =0.8×
=0.8× ![]() mol/L;
mol/L;
③中HCl溶解,溶液体积等于HCl的体积,所得盐酸的浓度为 ![]() =
= ![]() mol/L;
mol/L;
④中氨气溶解,溶液体积等于氨气的体积,所得氨水的浓度为 ![]() =
= ![]() mol/L,
mol/L,
故选:B.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4nH2O).
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是 .
(2)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油.
①在101KPa时,1.6g CH4(g)与H2O(g)反应生成CO、H2 , 吸热20.64kJ.则甲烷与H2O(g)反应的热化学方程式: .
②CH4不完全燃烧也可制得合成气:CH4(g)+ ![]() O2(g)═CO(g)+2H2(g);
O2(g)═CO(g)+2H2(g);
△H=﹣35.4kJmol﹣1 . 则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为(填序号);原因是 .
(3)利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)=CH3OH(g)△H1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)=CO(g)+H2O(g)△H3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
化学键 | H﹣H | C﹣O | C≡O | H﹣O | C﹣H |
E/(kJmol﹣1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算△H1=kJmol﹣1 , 已知△H2=﹣58kJmol﹣1 , 则△H3=kJmol﹣1 .
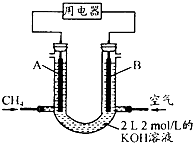
(4)可燃冰中CH4的其它用途是,将CH4设计成燃料电池,其利用率更高,装置示意图(A、B为多孔性碳棒).持续通人甲烷,在标准状况下,消耗甲烷体积VL.
①O<V≤44.8L时,电池总反应方程式为 ,
②44.8L<V≤89.6L时,负极电极反应为 .