题目内容
5.常温下向下列溶液中加入足量的铁,充分反应后,生成气体最多的是( )| A. | 20mL 12mol/L的盐酸 | B. | 10mL 18mol/L的硫酸 | ||
| C. | 80 mL 2mol/L的硫酸 | D. | 40 mL 14mol/L的硝酸 |
分析 A.发生Fe+2HCl=FeCl2+H2↑,n(HCl)=2n(H2);
B.18mol/L的硫酸为浓硫酸,常温下与Fe发生钝化;
C.发生Fe+2H+=Fe2++H2↑,n(硫酸)=n(H2);
D.14mol/L的硝酸为浓硝酸,常温下与Fe发生钝化.
解答 解:A.发生Fe+2HCl=FeCl2+H2↑,n(HCl)=0.2L×12mol/L=2.4mol,则n(H2)=1.2mol;
B.18mol/L的硫酸为浓硫酸,常温下与Fe发生钝化,几乎不生产气体;
C.发生Fe+2H+=Fe2++H2↑,n(硫酸)=n(H2)=0.8L×2mol/L=1.6mol;
D.14mol/L的硝酸为浓硝酸,常温下与Fe发生钝化,几乎不生产气体,
显然C中生成气体最多,
故选C.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及反应中物质的量关系为解答的关键,注意铁足量及钝化的分析,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
15.科学研究证明:核外电子的能量不仅与电子所处的能层、能级有关,还与核外电子的数目及核电荷的数目有关.氩原子与硫离子的核外电子排布相同,都是1s22s22p63s23p6下列说法正确的是( )
| A. | 两粒子的1s能级上电子的能量相同 | |
| B. | 两粒子的3p能级上的电子离核的距离相同 | |
| C. | 两粒子都达8电子稳定结构,化学性质相同 | |
| D. | 两粒子的电子发生跃迁时,产生的光谱不同 |
20.下列原子的价电子构型中,第一电离能最小的是( )
| A. | 2s22p4 | B. | 3s23p4 | C. | 4s24p4 | D. | 5s25p4 |
10.最近医学界通过用14C标记的C60发现一种C60的羧酸衍生物,在特定条件下可以通过断裂DNA抑制艾滋病毒的繁殖,则有关14C的不正确叙述是( )
| A. | 14C与12C60中碳原子化学性质相同 | B. | 14C与14N的质量数相同 | ||
| C. | 14C是12C60的同素异形体 | D. | 14C与12C、13C互为同位素 |
14.二氧化氮与水的反应中,发生还原反应和氧化反应的物质的质量之比是( )
| A. | 3:1 | B. | 1:3 | C. | 2:1 | D. | 1:2 |
15.已知短周期元素a、b、c、d、e的原子序数依次增大、其氢化物中a、b、c、d、e的化合价如表,下列说法不正确的是( )
| 元素 | a | b | c | d | e |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A. | 元素a、c、d的最高价氧化物都属于酸性氧化物 | |
| B. | 元素c、d、e的氢化物稳定性和最高价氧化物对应水化物的酸性均依次增强 | |
| C. | 元素周期表中,元素c位于金属和非金属分界线附近,其单质常用作光电池材料 | |
| D. | 元素b、d、e的原子半径和离子半径均依次减小 |
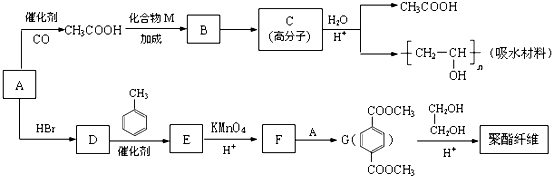
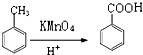
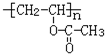 ,D→E的反应类型是取代反应.
,D→E的反应类型是取代反应.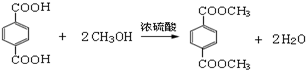 .
. .
. .
.