题目内容
【题目】下列说法中不正确的是
A. pH=a的氨水溶液,稀释10倍后,其pH=b,则b<a-1
B. pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液中c(Na+):③<②<①
C. 某温度Ksp(Ag2S)=6×10-50, Ksp(AgCl)=2×10-6, 则 2AgCl(s)+S2-(aq)![]() Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×1037
Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×1037
D. 一定浓度的 NaHS 溶液中:c(Na+)+c(OH-)==c(H+)+c(HS-)+2c(H2S)
【答案】A
【解析】A、pH=a的氨水溶液, c(OH-)=10-(14-a)mol/L,还含有没有电离的NH3·H2O,稀释10倍后,原有的OH-浓度变为c(OH-)2=10-(14-a)-1mol/L,同时稀释将导致氨水电离程度增大,原有的NH3·H2O部分电离,所以溶液中OH-浓度大于10-(14-a)-1mol/L,c(H+)<![]() ,pH=b>-lg101-a=a-1,A描述错误。B、由于酸性:CH3COOH>H2CO3>HClO,所以浓度相同的CH3COONa、NaHCO3、NaClO溶液,NaClO溶液水解程度最大,碱性最强pH最大,NaHCO3次之,CH3COONa水解程度最小,碱性最弱pH最小,那么要使三种溶液pH相同,以CH3COONa为基准,NaHCO3需要加入一定量的水进行稀释,NaClO需要加入更多的水进行稀释,即pH相等时三种溶液浓度③<②<①,所以此时Na+③<②<①,B描述正确。C、
,pH=b>-lg101-a=a-1,A描述错误。B、由于酸性:CH3COOH>H2CO3>HClO,所以浓度相同的CH3COONa、NaHCO3、NaClO溶液,NaClO溶液水解程度最大,碱性最强pH最大,NaHCO3次之,CH3COONa水解程度最小,碱性最弱pH最小,那么要使三种溶液pH相同,以CH3COONa为基准,NaHCO3需要加入一定量的水进行稀释,NaClO需要加入更多的水进行稀释,即pH相等时三种溶液浓度③<②<①,所以此时Na+③<②<①,B描述正确。C、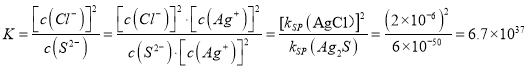 ,C描述正确。D、对于NaHS溶液,根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),根据Na与S元素原子数的等量关系,c(Na+)=c(H2S)+c(HS-)+c(S2-),以第二个式子的c(S2-) = c(Na+)-c(H2S)-c(HS-)带入第一个式子,化简得到c(Na+)+c(OH-)==c(H+)+c(HS-)+2c(H2S),D描述正确。正确答案A。
,C描述正确。D、对于NaHS溶液,根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),根据Na与S元素原子数的等量关系,c(Na+)=c(H2S)+c(HS-)+c(S2-),以第二个式子的c(S2-) = c(Na+)-c(H2S)-c(HS-)带入第一个式子,化简得到c(Na+)+c(OH-)==c(H+)+c(HS-)+2c(H2S),D描述正确。正确答案A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】今有室温下四种溶液,有关叙述不正确的是( )
① | ② | ③ | ④ | |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B. 分别加水稀释10倍,四种溶液的pH ①>②>④>③
C. ①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D. VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va∶Vb=11∶9
