题目内容
(8分)将32.64g铜与200mL一定浓度的硝酸反应,铜完全溶解产生的混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为 L,NO2的体积为 L(各保留二位有效数字)。
(2)待产生的气体全部释放后,向溶液加入VmL amol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水 g。
(1)NO的体积为 L,NO2的体积为 L(各保留二位有效数字)。
(2)待产生的气体全部释放后,向溶液加入VmL amol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水 g。
(1)5.8 5.4 (2) (3)57.8
(3)57.8
 (3)57.8
(3)57.8(1)硝酸的还原产物一般是NO和NO2,即混合气体是NO和NO2,其物质的量是 。32.64g铜是
。32.64g铜是 ,共失去电子0.51mol×2=1.02mol。根据得失电子守恒可知n(NO)×3+n(NO2)×1=1.02mol,又因为n(NO)+n(NO2)=0.5mol,所以n(NO)=0.26mol,n(NO2)=0.24mol,其体积分别是0.26mol×22.4L/mol=5.8L,11.2L-5.8L=5.4L。
,共失去电子0.51mol×2=1.02mol。根据得失电子守恒可知n(NO)×3+n(NO2)×1=1.02mol,又因为n(NO)+n(NO2)=0.5mol,所以n(NO)=0.26mol,n(NO2)=0.24mol,其体积分别是0.26mol×22.4L/mol=5.8L,11.2L-5.8L=5.4L。
(2)溶液中的Cu2+恰好全部转化成沉淀后,留在溶液中的就只有硝酸钠,根据钠原子守恒可知硝酸钠是0.001Vamol,再根据氮原子守恒可知,原硝酸的物质的量是(0.001Vamol+0.5mol),所以原硝酸溶液的浓度为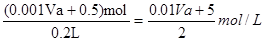 。
。
(3)若使NO和NO2气体全部转化为硝酸钠,则相当于硝酸从铜中得到的电子又被双氧水得到。因为双氧水的还原产物是水,即1molH2O2在反应中得到2mol电子,所以根据得失电子守恒可知需要双氧水的物质的量是 ,其质量为0.51mol×34g/mol=17.34g,因此需要30%的双氧水的质量是17.34g÷30%=57.8g。
,其质量为0.51mol×34g/mol=17.34g,因此需要30%的双氧水的质量是17.34g÷30%=57.8g。
 。32.64g铜是
。32.64g铜是 ,共失去电子0.51mol×2=1.02mol。根据得失电子守恒可知n(NO)×3+n(NO2)×1=1.02mol,又因为n(NO)+n(NO2)=0.5mol,所以n(NO)=0.26mol,n(NO2)=0.24mol,其体积分别是0.26mol×22.4L/mol=5.8L,11.2L-5.8L=5.4L。
,共失去电子0.51mol×2=1.02mol。根据得失电子守恒可知n(NO)×3+n(NO2)×1=1.02mol,又因为n(NO)+n(NO2)=0.5mol,所以n(NO)=0.26mol,n(NO2)=0.24mol,其体积分别是0.26mol×22.4L/mol=5.8L,11.2L-5.8L=5.4L。(2)溶液中的Cu2+恰好全部转化成沉淀后,留在溶液中的就只有硝酸钠,根据钠原子守恒可知硝酸钠是0.001Vamol,再根据氮原子守恒可知,原硝酸的物质的量是(0.001Vamol+0.5mol),所以原硝酸溶液的浓度为
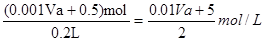 。
。(3)若使NO和NO2气体全部转化为硝酸钠,则相当于硝酸从铜中得到的电子又被双氧水得到。因为双氧水的还原产物是水,即1molH2O2在反应中得到2mol电子,所以根据得失电子守恒可知需要双氧水的物质的量是
 ,其质量为0.51mol×34g/mol=17.34g,因此需要30%的双氧水的质量是17.34g÷30%=57.8g。
,其质量为0.51mol×34g/mol=17.34g,因此需要30%的双氧水的质量是17.34g÷30%=57.8g。
练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
 CoCl2·xH2O 现有65g无水CoCl2,吸水后变成CoCl2·xH2O 119g。(1)水合物中x= ;(2)、若该化合物中Co2+的配位数为6,而且经测定得知内界和外界Cl-的个数比为1:1,则其化学式可表示为:
CoCl2·xH2O 现有65g无水CoCl2,吸水后变成CoCl2·xH2O 119g。(1)水合物中x= ;(2)、若该化合物中Co2+的配位数为6,而且经测定得知内界和外界Cl-的个数比为1:1,则其化学式可表示为:  数目为0.2NA
数目为0.2NA