题目内容
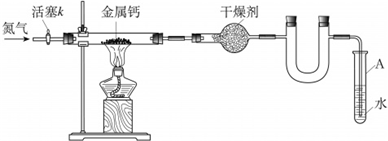
 某种由Al与Al2O3粉末组成的混合物样品,利用如图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如表:
某种由Al与Al2O3粉末组成的混合物样品,利用如图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如表:
| 读数次数 | 质量(g) | |
| 锥形瓶 + NaOH溶液 + 试样 | 第1次 | 188.30 |
| 第2次 | 188.28 | |
| 第3次 | 188.25 | |
| 第4次 | 188.24 | |
| 第5次 | 188.24 |
(2)反应中产生的氢气质量为______g
(3)求样品中Al的质量分数.______(要求有计算过程).
解:(1)铝和氢氧化钠反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)称量至恒重是需要的数据,依据图表数据可知,称重恒重的质量为188.24g,所以反应产生的氢气质量为188.30-188.24=0.06g
(3)依据反应可知,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,生成氢气0.03mol,需要铝物质的量为0.02mol;
样品中Al的质量为0.02mol×27=0.541g;则样品中Al的质量分数为 ×100%=20.9%;
×100%=20.9%;
故答案为:生成氢气0.03mol,需要铝物质的量为0.02mol;样品中Al的质量为0.02mol×27=0.541g;则样品中Al的质量分数为 ×100%=20.9%;
×100%=20.9%;
分析:(1)铝和氢氧化钠反应生成偏铝酸钠和氢气;
(2)称量至恒重是需要的数据,反应产生的氢气质量为188.30-188.24=0.06g
(3)样品中Al的质量为0.02mol×27=0.541g;则样品中Al的质量分数为 ×100%=20.9%;
×100%=20.9%;
点评:本题考查了实验称重的原则分析和数据处理的分析应用,铝的性质应用,注意反应前后称重的数据是称量至恒重误差小,题目难度中等.
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)称量至恒重是需要的数据,依据图表数据可知,称重恒重的质量为188.24g,所以反应产生的氢气质量为188.30-188.24=0.06g
(3)依据反应可知,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,生成氢气0.03mol,需要铝物质的量为0.02mol;
样品中Al的质量为0.02mol×27=0.541g;则样品中Al的质量分数为
 ×100%=20.9%;
×100%=20.9%;故答案为:生成氢气0.03mol,需要铝物质的量为0.02mol;样品中Al的质量为0.02mol×27=0.541g;则样品中Al的质量分数为
 ×100%=20.9%;
×100%=20.9%;分析:(1)铝和氢氧化钠反应生成偏铝酸钠和氢气;
(2)称量至恒重是需要的数据,反应产生的氢气质量为188.30-188.24=0.06g
(3)样品中Al的质量为0.02mol×27=0.541g;则样品中Al的质量分数为
 ×100%=20.9%;
×100%=20.9%;点评:本题考查了实验称重的原则分析和数据处理的分析应用,铝的性质应用,注意反应前后称重的数据是称量至恒重误差小,题目难度中等.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
 实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示).已知,固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行有关实验,下列说法错误的是
实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示).已知,固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行有关实验,下列说法错误的是